Une ère d’espoir dans le traitement du SCLC
Auteur:
Rami Manochakian, MD, FASCO
Hematology/Oncology Division
Mayo Clinic Comprehensive Cancer Center Jacksonville/Florida, USA
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Grâce aux progrès récents réalisés dans la prise en charge du cancer du poumon à petites cellules, les perspectives des patient·es atteint·es de cette maladie au pronostic notoirement défavorable commencent à s’améliorer enfin.
La première étape du traitement du carcinome pulmonaire à petites cellules (SCLC) consiste à déterminer si la maladie est à un stade limité (LS-SCLC) ou avancé (ES-SCLC).
Gestion du LS-SCLC
Pour la majorité des patient·es atteint·es de LS-SCLC, le traitement standard consiste en une chimioradiothérapie concomitante suivie d’une consolidation par durvalumab pendant deux ans. L’étude de référence ADRIATIC a montré, sous durvalumab, une prolongation cliniquement pertinente et statistiquement significative de la survie globale (OS) par rapport au placebo (médiane: 55,9 vs 33,4 mois; HR: 0,73).1 Les recherches actuelles portent sur la manière dont l’ADN tumoral circulant (ctDNA) pourrait guider l’immunothérapie dans le LS-SCLC. Dans une étude présentée au WCLC 2025, le statut de la ctDNAs’est révélé être un facteur à la fois pronostique et prédictif du bénéfice de l’inhibition du point de contrôle immunitaire.2
Pour un faible pourcentage de patient·es atteint·es de LS-SCLC, la résection chirurgicale est envisageable aux stades T1 ou T2 sans envahissement ganglionnaire (N0). Une chimiothérapie adjuvante à base de platine/étoposide est ensuite recommandée. En cas d’atteinte ganglionnaire, une chimioradiothérapie est préconisée.
Stratégies de première ligne pour l’ES-SCLC
Dans l’ES-SCLC, l’association d’une chimiothérapie (platine/étoposide) et d’une immunothérapie (atezolizumab ou durvalumab) suivie d’une «immuno-maintenance» demeure le standard de première ligne. Le bénéfice de l’ajout d’inhibiteurs de points de contrôle immunitaires à la chimiothérapie a été démontré dans les études IMpower-133 et CASPIAN.3,4 Les données de survie à long terme de l’étude IMbrella-A montrent un taux d’OS à cinq ans de 12% sous atezolizumab plus chimiothérapie.5
Plus récemment, l’étude IMforte a évalué l’ajout de lurbinectine à l’atezolizumab en maintenance après chimio-immunothérapie. Par rapport à l’atezolizumab seul, l’association a prolongé la survie sans progression (médiane: 5,4 vs 2,1 mois; HR: 0,54) ainsi que l’OS (13,2 vs 10,6 mois; HR: 0,73).6Malgré ces résultats encourageants, nombre d’experts estiment que le bénéfice en OS reste modéré et qu’il s’accompagne d’une toxicité accrue, venant peser sur la qualité de vie des patient·es ayant déjà reçu quatre cycles de chimiothérapie intensive. Les effets indésirables (EI) de grade 3/4 liés au traitement étaient significativement plus fréquents sous l’association (25,6% vs 5,8%), de même que les EI graves (31,0% vs 17,1%). Les patient·es présentant des métastases cérébrales étaient également exclu·es de l’étude. Compte tenu de ces éléments, l’ajout de lurbinectine à l’immunothérapie d’entretien de première ligne peut être discuté comme option pertinente chez certain·es patient·es éligibles.
Traitement de deuxième ligne de l’ES-SCLC: tarlatamab comme standard
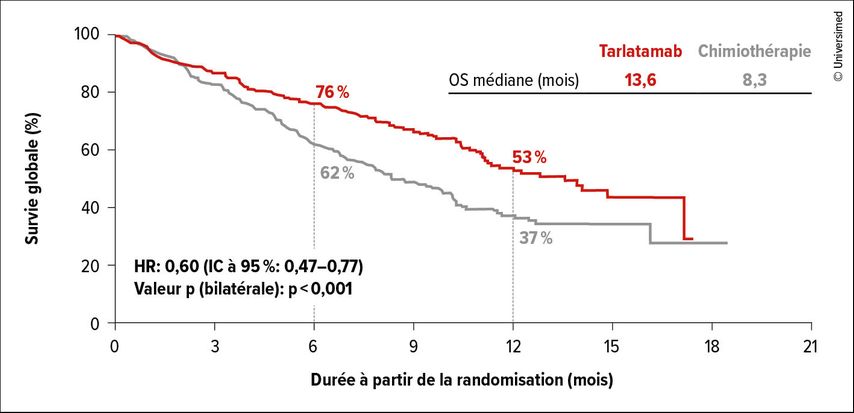
En deuxième ligne, une réintroduction de traitement platine-étoposide demeure envisageable, notamment en cas de longue période sans progression à la suite de la chimiothérapie de première ligne. Cependant, le tarlatamab s’impose désormais comme traitement standard privilégié et l’une des options les plus efficaces. Le tarlatamab est le premier agresseur bispécifique des cellules T approuvé pour le traitement du SCLC. L’étude pivot DeLLphi-304 a montré un allongement significatif de l’OS sous tarlatamab par rapport à la chimiothérapie, avec un gain de cinq mois (13,6 vs 8,3 mois; HR: 0,60; Fig.1), ainsi que des rémissions plus fréquentes et plus durables.7 Des améliorations significatives de la dyspnée et de la toux ont également été observées, un point essentiel pour des patient·es très symptomatiques. Le profil de sécurité du tarlatamab était globalement plus favorable que celui de la chimiothérapie; toutefois, certains EI spécifiques requièrent une vigilance particulière, notamment le syndrome de libération des cytokines (CRS) et le syndrome de neurotoxicité associée aux cellules immunitaires effectrices (ICANS). La majorité de ces événements étaient considérés comme étant de grade1 ou 2 dans l’étude. Une surveillance étroite dans des établissements médicaux appropriés est indispensable au cours des premiers cycles (la plupart des patient·es ont reçu les premiers cycles en milieu hospitalier).
Fig.1: Critère d’évaluation primaire de l’étude DeLLphi-304: avantage de survie sous tarlatamab vs chimiothérapie (modifiée selon Rudin et al.)7
Au vu de l’efficacité démontrée en deuxième ligne, le tarlatamab est désormais étudié à un stade plus précoce (maintien, première ligne). Dans l’étude de phaseIb DeLLphi 303, l’association tarlatamab + immunothérapie en maintenance après 4 à 6 cycles d’induction chimio-immunologique a montré un OS médian remarquable de 25,3 mois.8 Le taux de réponse global (ORR) était de 24%, avec une durée moyenne de réponse de 16,6 mois. 60% des patient·es ont obtenu un contrôle de la maladie. Un point important: aucun nouveau signal de sécurité n’a été identifié. D’autres agresseurs de cellules T bispécifiques dirigés contre DLL-3/CD3 ainsi que des anticorps trispécifiques sont actuellement en développement.
ADC dans le SCLC
Les conjugués anticorps-médicament (ADC) s’imposent comme une nouvelle classe de médicaments. Certaines molécules sont déjà approuvées dans d’autres cancers, et plusieurs ADC sont en développement actif dans le SCLC. Les pipelines contiennent des molécules ciblant B7H3, DLL3 et TROP2, la charge utile étant le plus souvent la topoisoméraseI. L’ADC ciblant B7H3, l’ifinatamab deruxtecan (I-DXd), a montré des taux de réponse prometteurs dans les lignées ultérieures dans l’étude de phaseII IDeate-Lung01.9La dose de 12mg/kg, I-DXd a permis d’obtenir un TRO de 56,3% et une OS médiane de 12,0 mois en deuxième ligne. Les EI associés au traitement étaient principalement hématologiques et gastro-intestinaux, le plus souvent de grade1 ou 2. Des pneumopathies interstitielles (PID)/pneumonites ont été observées dans 12,4% des cas.
Une autre étude, multicentrique, ouverte de phaseI a évalué l’ADC SHR-4849 ciblant DLL3 chez des patient·es atteint·es de SCLC métastatique exprimant DLL3 ainsi que d’autres carcinomes neuroendocrines, après progression ou rechute suivant un traitement standard.10 Le TRO observé avec SHR-4849 ≥2,4mg/kg en deuxième ligne était de 77,1%, illustrant le potentiel majeur de ces médicaments. Les EI demeurent toutefois un enjeu important, avec 52,0% des cas d’événements de grade ≥3.
Dans le cas du SCLC, les ADC des lignes ultérieures semblent offrir des taux de réponse supérieurs et une durée de réponse plus longue que les chimiothérapies. Actuellement, on ne sait pas si un ADC est meilleur que les autres et si les résistances à une substance permettent de conclure à l’inefficacité de tous les ADC. L’identification et la prise en charge précoces des EI sont essentielles, notamment en ce qui concerne les PID et les cytopénies.
Globalement, nous vivons clairement une ère d’espoir, portée par des thérapies innovantes pour les patient·es atteint·es de SCLC. Même si le chemin reste long, les progrès accomplis sont considérables.
Littérature:
1 Spigel D et al.: J Clin Oncol 2024; 42 (Suppl. 17): LBA5 2 Bi N et al.: Circulating tumor DNA refines consolidation immunotherapy for limited-stage SCLC. WCLC 2025; Abstr. # MA11.09 3 Horn L et al.: N Engl J Med 2018; 379(23): 2220-9 4 Paz-Ares L et al.: Lancet 2019; 394(10212): 1929-39 5 Liu SV et al.: Five-year survival in patients with ES-SCLC treated with atezolizumab in IMpower133: IMbrella A extension study results. WCLC 2023; Abstr. #OA01.04 6 Paz-Ares L et al.: J Clin Oncol 2025; 43(Suppl. 16): 8006 7 Rudin C et al.: JClin Oncol 2025; 43(Suppl. 17): Abstr. #LBA8008 8 Paulson KG et al.: Lancet Oncol 2025; 26(10): 1300-11 9 Rudin CM et al.: J Clin Oncol 2025: 101200JCO2502142 10 Wang L et al.: A first-in-human phase1 study of SHR-4849 (IDE849), a DLL3-directed antibody-drug conjugate, in relapsed SCLC. WCLC 2025; Abstr. #OA06.01
Das könnte Sie auch interessieren:
Infection par le VIH chez les personnes âgées: quels sont les défis?
Grâce aux progrès de la médecine, le VIH est aujourd’hui une maladie chronique qui peut être traitée et les patient·es peuvent avoir une espérance de vie presque normale. De plus en plus ...
Traitement par des anticorps dans la BPCO: premières autorisations et nombreuses questions en suspens
Les premiers médicaments biologiques ont désormais été autorisés dans l’indication de la BPCO pour réduire le risque d’exacerbation. Plusieurs autres médicaments biologiques font l’objet ...
Médicaments biologiques dans l’asthme sévère: l’embarras du choix
Pour le traitement de l’asthme bronchique sévère, six anticorps monoclonaux aux cibles différentes sont actuellement autorisés dans l’UE et en Suisse. Les biomarqueurs aident à choisir ...