Neue Therapiekonzepte bei BCR/ABL-negativen myeloproliferativen Neoplasien
Autor:
Univ.-Prof. Dr. Klaus Geissler
Facharzt für Hämatologie und internistische Onkologie
Professor für Hämatoonkologie
Sigmund Freud PrivatUniversität, Wien
E-Mail: geissler.klaus@gmx.at
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die Behandlung myeloproliferativer Neoplasien (MPN) hat seit der Jahrtausendwende vor allem durch die Einführung von Tyrosinkinase-Inhibitoren große Fortschritte gemacht. In den folgenden Jahren wurde sowohl bei der cronischen myeloischen Leukämie (CML) als auch im Bereich der BCR/ABL-negativen MPN durch Weiterentwicklung der ursprünglichen Therapiekonzepte wie der BCR/ABL-Hemmung durch Imatinib und der JAK2-Hemmung durch Ruxolitinib eine weitere Optimierung der Therapiemöglichkeiten erreicht. Während es beim EHA-Jahrestreffen 2025 im Bereich der MPN kaum praxis-ändernde Daten gab, wurden einige völlig neue Therapiekonzepte präsentiert, von denen erwartet werden kann, dass sie einen Beitrag zur weiteren Verbesserung nach wie vor persistierender Probleme beim Management von MPN leisten könnten.
Neue Therapiekonzepte – klinische Studien
MANIFEST-2: Pela+Ruxolitinib
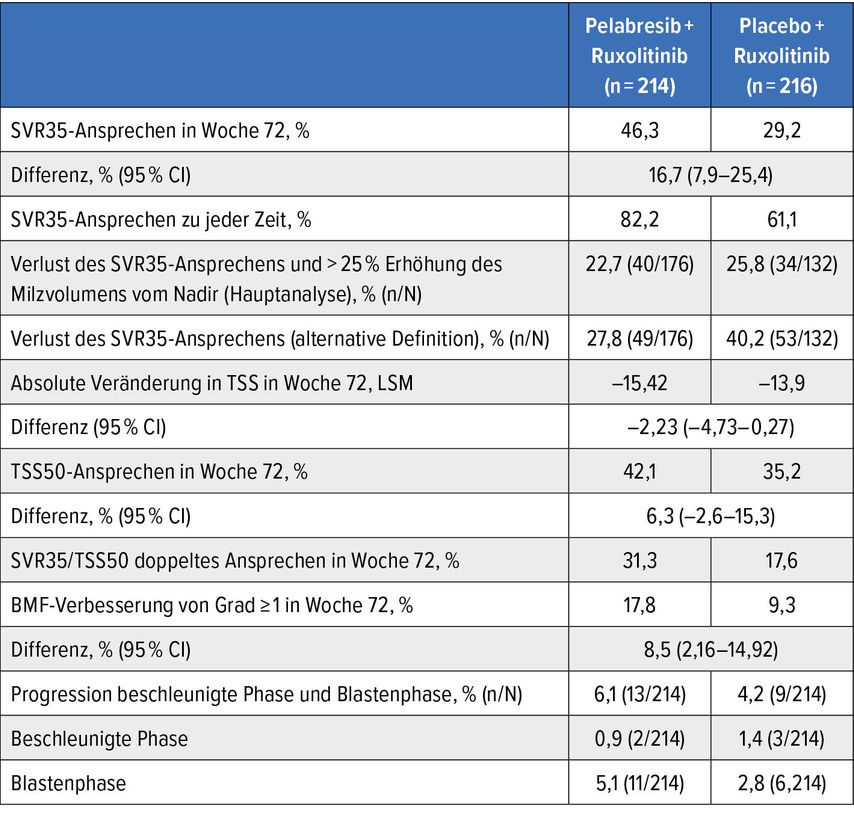
Pelabresib (Pela) ist ein neuer, oralerBET-Inhibitor, der im Rahmen der Studie MANIFEST-2 bei JAK-Inhibitor-naiven Patient:innen mit Myelofibrose (MF) untersucht wurde.1 In dieser Studie, die von Vannucchi et al. präsentiert wurde, wurden Patient:innen mit MF-DIPSS ≥1Int-1-risk, Thrombozytenzahlen ≥100G/l, Milzvolumen ≥450cm3, ≥2 Symptome mit einem Durchschnittsscore ≥3 oder einem Total-Symptom-Score (TSS) ≥10, einem Blastzellanteil <5% und ECOG-Status ≤2 eingeschlossen.Patient:innen wurden 1:1 randomisiert in Pela+Ruxolitinib (Rux) oder Placebo(Pbo)+Rux.
Die Endpunkte der Studie waren eine Verminderung des Milzvolumens um ≥35% (SVR35), die absolute Veränderung des TSSund eine TSS50 (≥50% Verminderung gegenüber Baseline) nach 72 Wochen. Die Ergebnisse dieser Studie sind in Tabelle1 dargestellt. Pela+Rux zeigte eine andauernde Verbesserung im Hinblick auf Milzansprechen, Symptome, SVR35/TSS50-Zweifachansprechen, Knochenmarkfibrose und Anämie gegenüber Pbo+Rux.
Das Sicherheitsprofil für Nebenwirkungen von Grad≥3 war ähnlich in beiden Behandlungsarmen. Die Überlebenszeit zeigte einen Trend zugungsten Pela+Rux. Insgesamt zeigen die Ergebnisse einen klinisch relevanten Benefit von Pela+Rux gegenüber Rux alleine mit Hinweis auf ein krankheitsmodifizierendes Potenzial und mit einer möglichen Überlebensverlängerung.
PREACH-M: Azacitidin+Lenzilumab
In der Pathophysiologie der chronischen myelomonozytären Leukämie (CMML) spielt der Wachstumsfaktor GM-CSF eine entscheidende Rolle.2
PREACH-M ist eine nichtrandomisierte, unkontrollierte, offene Phase-II/III-Studie mit 54 Patient:innen mit CMML.3 Patient:innen mit Mutationen im Bereich des RAS-Signalpfades (NRAS, KRAS, CBL) erhielten alle Monate Azacitidin (s.c. 75mg/m2) und den Anti-GM-CSF-Antikörper Lenzilumab (Lenz; i.v. 552mg Tag 1 und 15 in Zyklus 1, und Tag 1 bei allen folgenden Zyklen).
20 Patient:innen wurden für den Lenz/Aza-Arm rekrutiert. Zum Zeitpunkt der Auswertung hatten die Patient:innen im Median 13,5 Zyklen erhalten. Nach dem CPSS-Mol-Score waren in der Risikokategorie „intermediate-1“ bei einem Patienten, in der Kategorie „internediate-2“ bei zwölf Patient:innen und in der Kategorie „high risk“ bei sechs Patient:innen die Daten auswertbar. Insgesamt erreichten 85% der Patient:innen innerhalb eines Jahres eine komplette Remission (CR) oder eine „marrow CR“ (mCR) nach den IWG-2006-Kriterien.
Interessanterweise hatten 64% der Patient:innen mit Ansprechen auf diese Therapie eine CBL-Mutation zum Zeitpunkt der Diagnose. Von den zehn Patient:innen mit dominanter CBL-Mutation (VAF>10%) erreichten 90% eine CR oder mCR innerhalb der ersten zwölf Monate mit dauerhafter Unterdrückung der CBL-Klone. Diese Interimsanalyse der Studie PREACH-M zeigt vielversprechende Ergebnisse der Lenz/Aza-Therapie mit einer CR/mCR-Rate von 85% ohne signifikante Lenz-assoziierte Toxizität.
PIM-Inhibitor: Nuvisertib
PIM1 („proviral integration site for Moloney murine leukemia virus-1“) ist eine Serin/Threonin-Proteinkinase, die hauptsächlich die Zytokin-induzierte Signaltransduktionskaskade beeinflusst. Die Transkription von PIM1 wird durch STAT3 und STAT5 initiiert. Das Gen wird hauptsächlich in B-lymphatischen und myeloischen Zelllinien exprimiert und ist überexprimiert in hämatopoetischen Malignomen mit schlechter Prognose und beim Prostatakarzinom.
Nuvisertib ist ein PIM-Inhibitor, der im Rahmen einer Phase-I/II-Studie bei Patient:innen mit MF untersucht wurde, die refraktär oder ungeeignet für eine JAK-Inhibitor-Therapie waren, den Kategorien „DIPSS intermediate“ oder „DIPSS high“ zugeordnet waren, Thrombozytenwerte >25G/l aufwiesen, eine Splenomegalie ≥450cm3 und ≥2 messbare Symptome nach MFSAF v4.0 hatten.4
Insgesamt 77 Patient:innen erhielten fünf Dosisstufen von 480mg einmal täglich bis 720mg zweimal täglich. Es trat keine dosislimitierende Toxizität auf. Behandlungsassoziierte Nebenwirkungen von Grad 1/2 inkludierten Durchfall, Übelkeit und Erbrechen. Eine Toxizität von Grad≥3 bei ≥3 Patient:innen wurde für Thrombopenie beobachtet.
Bei Patient:innen, die Nuvisertib 720mg zweimal täglich erhielten, war ein ≥25% SVR bei 4/8 (22%) Patient:innen und eine ≥50%ige Reduktion von TSS bei 8/18 (44%) Patient:innen zu sehen. Das TSS50-Ansprechen war für mindestens zwölf Wochen anhaltend und die Verbesserung der Symptome korrelierte mit einer Modulation der Zytokine. 6 von 25 (24%) Patient:innen mit Hb <10 zeigten einen Hb-Anstieg ≥1g/dl und eine Transfusionsunabhängigkeit für mindestens zwölf Wochen, 8 von 30 (26,7%) mit Thrombozytenwerten <100G/l zeigten ein Ansprechen ≥30G/l.
Zusammenfassend scheint eine Monotherapie mit Nuvisertib gut tolerabel zu sein. Darüberhinaus sprechen die präliminären Ergebnisse betreffend AVR25, Symptomverbesserung mit gleichzeitiger Zytokinmodulation, die Verminderung der Knochenmarkfibrose sowie die günstigen Effekte auf Erythropoese und Thrombopoese für eine weitere Entwicklung dieses Medikaments in Kombination mit den bisherigen JAK2-Inhibitoren.
RESTORE: Elritercept
Ein abnormes Signalverhalten im Bereich des JAK2- und TGF-ß-Pfades ist bei MF-Ursache der ineffektiven Erythropoese, der Splenomegalie, der konstitutionellen Symptome und der Zytopenie.
Devos et al. präsentierten die Phase-II-Studie RESTORE, in der Patient:innen mit MF mit dem Aktivinrezeptor-Typ-IIA-Liganden-neutralisierenden Elritercept als Monotherapie oder in Kombination mit Ruxolitinib behandelt wurden.5 Effekte auf Anämie, Milzgröße und Symptome wurden berichtet. Abbildung1 zeigt die Hb-Anstiege im Monotherapie- und Kombinationsarm bei transfusionsunabhängigen Patient:innen und die Verminderung der Transfusionen bei transfusionsabhängigen Patient:innen.
Abb. 1: Hb-Anstiege im Monotherapie- und Kombinationsarm bei transfusionsunabhängigen Patient:innen und die Verminderung der Transfusionen bei transfusionsabhängigen Patient:innen (modifiziert nach Devos T et al.)5
Elritercept wurde gut toleriert und zeigte das Potenzial, multiple Aspekte der MF zu verbessern. Die beobachteten Verbesserungen bei Hb und Transfusionen sowie ein günstiger Effekt auf die Thrombopoese unterstützen den Einsatz bei Zytopenie. Verkleinerungen des Milzvolumens und Verbesserungen bei Symptomen wurden sowohl bei der Monotherapie mit Elritercept als auch bei Kombination mit Rux beobachtet.
SANRECO: Gen-Silencing mit Elritercept
In der Studie SANRECO wurde bei Patient:innen mit Polycythaemia vera (PV) mithilfe der GalNAc-konjugierten „19-mer short interfering RNA“ Divesiran der Negativregulator der Hepcidin-Produktion, TMPRSS6, durch Gen-Silencing ausgeschaltet und dadurch die Hepcidinsynthese gesteigert.6
Divesiran wurde gut vertragen und zeigte keine dosislimitierende Toxizität. Nach Beginn der Divesiran-Verabreichung benötigten keine Patient:innen, die einen HK<45% aufwiesen, einen weiteren Aderlass oder erlitten eine thrombotische Komplikation. Divesiran induzierte einen mehr als 40-fachen Anstieg des Hepcidins als Zeichen des angestrebten Effektes.
Divesiran ist somit die erste siRNA-Methode, mit der die Hepcidinsynthese gesteigert werden kann und die somit als potenzielle Behandlungsstrategie bei PV weiterentwickelt werden wird.
Neue Erkenntnisse im Bereich bestehender Therapiekonzepte
Neue Erkenntnisse bei bereits eingesetzten Therapien wurden ebenfalls berichtet. Die Studie SURPASS-ET ist eine aktiv kontrollierte, offene, multizentrische Phase-III-Untersuchung, in der Ropeg gegenüber Anagrelid über zwölf Monate bei Patient:innen mit essenzieller Thrombozythämie (ET), die resistent oder intolerant gegenüber Hydoxyurea (HU) waren, verglichen wurde.7
Der primäre Endpunkt der Studie war der Anteil der Patient:innen, die ein dauerhaftes Ansprechen sowohl im Monat 9 als auch im Monat 12 entsprechend den „Modified European LeukemiaNet“-Kriterien erreichten. Insgesamt erreichten im Ropeg-Arm 42,9% und im Anagrelid-Arm 6% der Patient:innen diesen Endpunkt.
In dieser Indikation übertraf Ropeg Anagrelid betreffend Wirksamkeit, Sicherheit und molekulares Ansprechen. Das eröffnet dieser Therapie als bessere Zweitlinienoption bei Patient:innen mit ET ein zusätzliches Einsatzgebiet neben der etablierten Rolle bei PV.
Im Moment ist der optimale Beginn einer Ropeg-Therapie bei Patient:innen mit MF unklar. In einer weiteren Studie von Gill et al. wurden 71 Patient:innen mit Prä-MF, DIPPS „low“ bis „intermediate“ primären oder sekundären MF mit Ropeg-Interferon behandelt.8
Bei einer medianen Beobachtungszeit von 119 Wochen zeigte sich um Woche 52 ein Ansprechen betreffend Hb bei 76,2%, betreffend Leukozytenzahl bei 79,4% und betreffend Thrombozytenzahl bei 100%. Eine Verminderung der JAK2-VAF fand sich bei 16/47 (34%) in Woche 24 und bei 20/41 (44%) in Woche 52. Eine Verminderung der CALR-VAF zeigte sich bei 10/19 (53%) in Woche 24 und bei 6/14 (43%) in Woche 52. Eine Reduktion der Symptome >50% wurde bei 27/63 (42,9%) in Woche 24 und 23/57 (42,1%) in Woche 52 beobachtet. Thrombohämorrhagische Ereignisse oder Progression in eine Blastenphase wurden nicht registriert.
Zusammenfassend konnte gezeigt werden, dass Ropeg gut toleriert wurde und klinisches, hämatologisches und molekulares Ansprechen bei Patient:innen mit Prä-MF und „low/intermediate-1-risk MF“ zeigte.
Literatur:
1 Vannucchi A et al.: Pelabresib in combination with ruxolitinib for Janus kinase inhibitor-naive patients with myelofibrosis: 72-week follow-up with long-term efficacy outcomes of the phase III MANIFEST-2 study. EHA 2025; Abstr. #S223 2 Geissler K et al.: Interleukin 10 inhibits growth and granulocyte/macrophage colony-stimulating factor production in chronic myelomonocytic leukemia. Cells J Exp Med 1996; 184(4): 1377-84 3 Thomas D et al.: Durable responses to lenzilumab-azacitidine combination therapy in high risk proliferative CMML with suppression of CBL and RAS mutant subclones. EHA 2025; Abstr. #S179 4 Rein L et al.: Preliminary data from phase I/II study of nuvisertib, an oral investigational selective PIM1 inhibitor, showed clinical response correlating with cytokine modulation in patients with myelofibrosis. EHA 2025; Abstr. #S221 5 Devos T et al.: HEMATOlogical improvement and other clinical benefits of elritercept as monotherapy and in combination with ruxolitinib in participants with myelofibrosis (MF) from the ongoing phase 2 RESTORE trial. EHA 2025; Abstr. #S220 6 Kremyanskaya M et al.: SANRECO, an on-going phase 1/2 study evaluating divesiran, anovel galnac-conjugated sirna, in patients with polycythemia vera. EHA 2025; Abstr. #S224 7 Gill H et al.: Better safety and efficacy with ropeginterferon alfa-2B over anagrelide as second-line treatment of essential thrombocythemia in the topline results of the randomized phase 3 SURPASS-ET trial. EHA 2025; Abstr. #S102 8 Gill H et al.: Ropeginterferon alfa-2b for pre-fibrotic primary myelofibrosis and dipss low/intermediate-risk myelofibrosis. EHA 2025; Abstr. #S222
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...