Die palliative Erstlinientherapie
Autor:
Apl. Prof. Priv.-Doz. Dr. med. univ. Florian Huemer
Universitätsklinik für Innere Medizin III mit Hämatologie, internistischer Onkologie, Hämostaseologie, Infektiologie, Rheumatologie und Onkologisches Zentrum, Uniklinikum Salzburg
E-Mail: f.huemer@salk.at
Das prädiktive Biomarkerpanel und das therapeutische Armamentarium für die Behandlung des fortgeschrittenen Magen- und Adenokarzinoms des gastroösophagealen Übergangs erweitern sich laufend. Die Wahl der palliativen Erstlinientherapie wird durch den Biomarkerstatus sowie das Therapieziel bestimmt und kann bei überlappendem Biomarkerprofil herausfordernd sein.
Keypoints
-
Bei Mismatch-Repair-Defizienz (MMRd) bzw. Mikrosatelliteninstabilität (MSI-H) sollte eine Immuncheckpoint-Inhibitor-basierte Therapie unabhängig vom sonstigen Biomarkerprofil erfolgen.
-
Die Erstlinientherapie der Wahl für HER2-positive Tumoren ist Chemotherapie+Trastuzumab (bei PD-L1-CPS <1) bzw. zusätzlich in Kombination mit Pembrolizumab (bei PD-L1-CPS ≥1).
-
Bei gleichzeitiger Claudin-18.2-Positivität (≥75% IHC2+/3+) und PD-L1-Positivität entscheiden unter anderem der exakte PD-L1-Status sowie die Notwendigkeit eines Therapieansprechens über die Wahl der Systemtherapie in der Erstlinie.
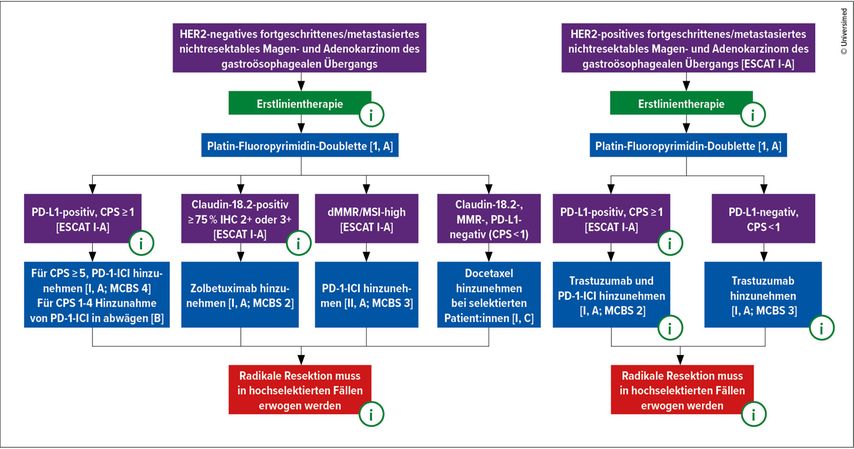
Seit der Etablierung der zielgerichteten anti-HER2-basierten Therapie beim metastasierten Magen- und Adenokarzinom des gastroösophagealen Übergangs (AEG) vergingen einige Jahre, bis Immun-Checkpoint-Inhibitoren Einzug in die palliative Erstlinientherapie gefunden haben. Das Spektrum (potenzieller) prädiktiver Biomarker erweitert sich nun stetig. Die aktuellen „ESMO Gastric Cancer Living Guidelines“ (Abb.1) sowie die Onkopedia-Leitlinien zum Magenkarzinom empfehlen die standardisierte Testung des Mismatch-Repair-/Mikrosatellitenstatus (MMRd: Mismatch-Repair-Defizienz, MSI-H: Mikrosatelliteninstabilität), des HER2-Status und des PD-L1-Status (CPS und/oder TAP) sowie des Claudin-18.2-Status und geben u.a. basierend auf dem letztgenannten Biomarkerprofil Empfehlungen für die palliative Erstlinientherapie.1,2
Trotz niedriger Frequenz der MMRd/MSI-H (4–7%) handelt sich um einen prädiktiven Biomarker mit hoher therapeutischer Konsequenz, da im Falle von MMRd/MSI-H eine Immuncheckpoint-Inhibitor-basierte (Anti-PD-1-) Therapie erfolgen sollte. Basierend auf gepoolten Analysen (Studien CheckMate-649, KEYNOTE-859, RATIONALE-305) konnte in diesem Kollektiv ein medianes Gesamtüberleben von >3 Jahren mit kombinierter Immuncheckpoint-Blockade+Chemotherapie ab Beginn der palliativen Erstlinientherapie erzielt werden.3 Aufgrund der Reduktion des Risikos für eine vorzeitige Krankheitsprogression wird zumindest eine temporäre Hinzunahme der Chemotherapie zur Immuncheckpoint-Inhibitor-Therapie empfohlen.4 Der PD-L1-Status hat keinen Einfluss auf die Effektivität der Immuntherapie bei einer MMRd/MSI-H-Situation.5
Die HER2-Testung wird in der klinischen Routine seit 2010 durchgeführt, basierend auf der Verbesserung der Ergebnisse der klinischen Endpunkte inklusive der Verlängerung des Gesamtüberlebens (HR: 0,65) durch die Hinzunahme von Trastuzumab zur Chemotherapie bei HER2+ Erkrankung (ca. 20%).6,7
In der Studie KEYNOTE-811 konnten durch die Hinzunahme von Pembrolizumab zu Trastuzumab und Chemotherapie die Gesamtansprechrate und die Raten des progressionsfreien Überlebens und des Gesamtüberlebens (HR: 0,79) in der PD-L1-CPS-≥1-Gruppe statistisch signifikant verbessert werden (PD-L1-Positivität bei ca 85% der Patient:innen mit HER2+ Erkrankung), während dies in der PD-L1-CPS-negativen Kohorte nicht der Fall war.8 Aufgrund letzterer Resultate wird die Hinzunahme eines Immuncheckpoint-Inhibitors bei HER2+ Erkrankung nur bei gleichzeitiger PD-L1-CPS-Positivität empfohlen. Aufgrund der therapeutischen Implikationen sollte zur Verifizierung der HER2-Positivität der HER2-Status grundsätzlich zentral bestimmt werden.7
Bei PD-L1-positiven Tumoren (CPS/TAP ≥1 [%] bei ca. 80%, ≥5 [%] bei ca. 55–60%) sind insgesamt drei PD-1-gerichtete Antikörper für die palliative Erstlinienbehandlung in Kombination mit Chemotherapie mit individuellen PD-L1-Cut-offs durch die Europäische Arzneimittelbehörde (EMA) zugelassen:9–11
-
Nivolumab (CheckMate-649: PD-L1-CPS ≥5)
-
Pembrolizumab (KEYNOTE-859: PD-L1-CPS ≥1)
-
Tislelizumab (RATIONALE-305: PD-L1-TAP ≥5%)
Rezente gepoolte Analysen aus diesen drei Studien haben zwei wichtige zusätzliche Erkenntnisse gebracht:3
Unabhängig vom Ausmaß der PD-L1-Expression kann die Immuncheckpoint-Inhibitor-Therapie die Gesamtansprechrate erhöhen.12 Seit September 2024 wurde das therapeutische Armamentarium um den gegen Claudin-18.2 gerichteten monoklonalen Antikörper Zolbetuximab durch die entsprechende EMA-Zulassung bei Claudin-18.2-Positivität erweitert (IHC 2+/3+ bei ≥75% der Tumorzellen). Die Zulassung beruht auf den positiven Studien SPOTLIGHT und GLOW, die einen Vorteil im progressionsfreien Überleben und Gesamtüberleben (HR: 0,75–0,77) durch die zusätzliche Gabe von Zolbetuximab zur Chemotherapie bei Claudin-18.2-Positivität (24–38%) und gleichzeitiger HER2-Negativität zeigen konnten.13,14 Diskordant zur Phase-II-Studie FAST konnte Zolbetuximab die Gesamtansprechrate in den Phase-III-Studien nicht verbessern.13–15
Das Auftreten von (höhergradiger) Nausea und Emesis war in den Studien GLOW und SPOTLIGHT im Zolbetuximab-Arm gegenüber der Kontrollgruppe deutlich erhöht und führte bei ca 10% der Patient:innen zum Therapieabbruch.16 Mit diesem „On-target-off-tumor“-Effekt (Claudin-18.2-Expression im gesunden Magenparenchym) können die hohe Frequenz und das größere Ausmaß der Nausea und Emesis v.a. bei Patient:innen ohne Gastrektomie insbesondere bei Erstgaben erklärt werden. Zolbetuximab ist als hochemetogene Substanz zu klassifizieren und eine antiemetische Vierfachprophylaxe wird empfohlen.
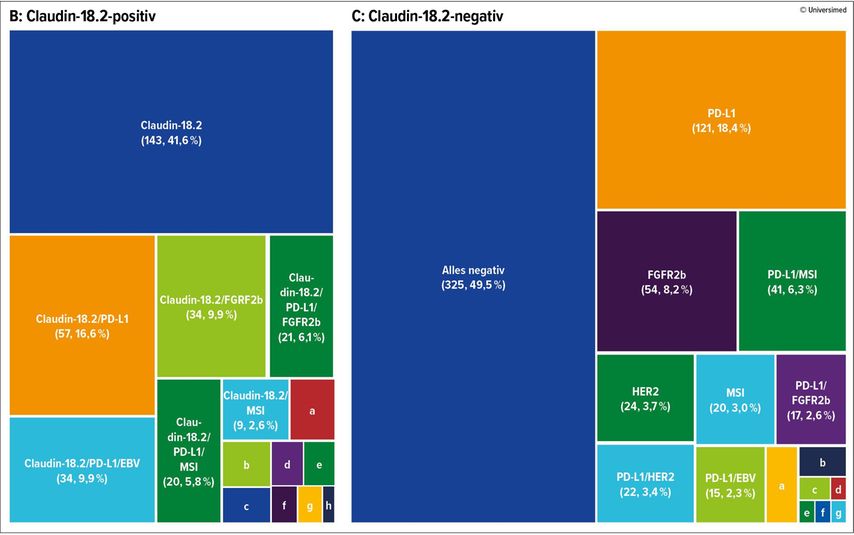
Die gleichzeitige PD-L1- und Claudin-18.2-Positivität kann im klinischen Alltag für die Wahl der palliativen Erstlinientherapie eine Herausforderung darstellen (Abb.2).17 In dieser Konstellation sollten der exakte PD-L1-Status (CPS/TAP intermediär 1–9 [%] vs. ≥10 [%]), die Notwendigkeit eines Therapieansprechens und der Performance-Status für die Entscheidung zwischen einer zusätzlichen Immuncheckpoint-Inhibitor-Therapie oder Zolbetuximab berücksichtigt werden.
Abb. 2: Prädiktives Biomarkerprofil Magenkarzinom und Adenokarzinom des gastroösophagealen Übergangs
Neuer prädiktiver Biomarker und zielgerichtete Therapie am Horizont?
Das prädiktive Biomarkerspektrum und das therapeutische Armamentarium könnten in absehbarer Zeit eventuell sogar erweitert werden. Bei FGFR2b-positiven Tumoren (IHC 2+/3+ bei ≥10% der Tumorzellen) wurden in der Phase-II-Studie FIGHT das progressionsfreie Überleben (HR: 0,43) und das Gesamtüberleben (HR: 0,52) durch Hinzunahme des gegen FGFR2b gerichteten Antikörpers Bemarituzumab gegenüber alleiniger Chemotherapie in klinisch relevantem Ausmaß und statistisch signifikant verlängert. FGFR2b-Positivität basierend auf diesem Cut-off ist bei ca. 11% der Patient:innen nachzuweisen.18
Die Ergebnisse von zwei randomisierten Phase-III-Studien (FORTITUDE-101 und FORTITUDE-102) werden mit Spannung erwartet. Sie werden die Frage beantworten, ob eine neue zielgerichtete Therapie Einzug in die palliative Erstlinientherapie halten und somit gleichzeitig das Spektrum „Biomarker-negativer“ Patient:innen weiter schrumpfen wird.
Fazit
Während sich das Therapiespektrum schrittweise erweitert, wird die Auswahl der idealen Erstlinientherapie im Falle von Biomarkerüberschneidungen eine zunehmende Herausforderung darstellen. Laufende prospektive, randomisierte Kombinationsstudien (z.B. FORTITUDE-102) können hoffentlich Antworten auf diese Fragen liefern.
Literatur:
1 ESMO Gastric Cancer Living Guideline. Online unter: https://www.esmo.org/living-guidelines/esmo-gastric-cancer-living-guideline/metastatic-disease/metastatic-disease , abgerufen am 29.4.2025 2 Onkopedia Leitlinien – Magenkarzinom. Online unter https://www.onkopedia.com/de/onkopedia/guidelines/magenkarzinom/@@guideline/html/index.html , abgerufen am 29.4.2025 3 FDA Briefing Document: Immune checkpoint inhibitors in patients with metastatic or unresectable HER2-negative gastric adenocarcinom. Oncology Advisory Committee Meeting, 26.9.2024. Online unter https://www.fda.gov/media/182138/download , abgerufen am 29.4.2025 4Shitara K et al.: Efficacy and safety of pembrolizumab or pembrolizumab plus chemotherapy vs chemotherapy alone for patients with first-line, advanced gastric cancer: the KEYNOTE-062 phase 3 randomized clinical trial. JAMA Oncol 2020; 6(10): 1571-80 5 Andre T et al.: Neoadjuvant nivolumab plus ipilimumab and adjuvant nivolumab in localized deficient mismatch repair/microsatellite instability-high gastric or esophagogastric junction adenocarcinoma: the GERCOR NEONIPIGA phase II study. J Clin Oncol 2023; 41(2): 255-65 6 Bang YJ et al.: Trastuzumab in combination with chemotherapy vs. chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial. Lancet 2010; 376(9742): 687-97 7 Huemer F et al.: Local and central evaluation of HER2 positivity and clinical outcome in advanced gastric and gastroesophageal cancer--results from the AGMT GASTRIC-5 registry. J Clin Med 2020; 9(4): 935 8 Janjigian YY et al.: Pembrolizumab in HER2-positive gastric cancer. N Engl J Med 2024; 391(14): 1360-2 9 Janjigian YY et al.: First-line nivolumab plus chemotherapy vs. chemotherapy alone for advanced gastric, gastro-oesophageal junction, and oesophageal adenocarcinoma (CheckMate 649): arandomised, open-label, phase 3 trial. Lancet 2021; 398(10294): 27-40 10 Rha SY et al.: Pembrolizumab plus chemotherapy vs. placebo plus chemotherapy for HER2-negative advanced gastric cancer (KEYNOTE-859): a multicentre, randomised, double-blind, phase 3 trial. Lancet Oncol 2023; 24(11): 1181-95 11 Qiu MZ et al.: Tislelizumab plus chemotherapy vs. placebo plus chemotherapy as first line treatment for advanced gastric or gastro-oesophageal junction adenocarcinoma: RATIONALE-305 randomised, double blind, phase 3 trial. BMJ 2024; 385: e078876 12Janjigian YY et al.: Nivolumab (NIVO) + chemotherapy (chemo) vs chemo as first-line (1L) treatment for advanced gastric cancer/gastroesophageal junction cancer/esophageal adenocarcinoma (GC/GEJC/EAC): 5-year (y) follow-up results from CheckMate 649. J Clin Oncol 2025; 43(Suppl 4): Abstr. #24013Shitara K et al.: Zolbetuximab plus mFOLFOX6 in patients with Claudin-18.2-positive, HER2-negative, untreated, locally advanced unresectable or metastatic gastric or gastro-oesophageal junction adenocarcinoma (SPOTLIGHT): a multicentre, randomised, double-blind, phase 3 trial. Lancet 2023; 401(10389): 1655-68 14 Shah MA et al.: Zolbetuximab plus CAPOX in Claudin-18.2 -positive gastric or gastroesophageal junction adenocarcinoma: the randomized, phase 3 GLOW trial. Nat Med 2023; 29(8): 2133-41 15Sahin U et al.: FAST: a randomised phase II study of zolbetuximab (IMAB362) plus EOX vs. EOX alone for first-line treatment of advanced Claudin-18.2 -positive gastric and gastro-oesophageal adenocarcinoma. Ann Oncol 2021; 32(5): 609-19 16 Shitara K et al.: Zolbetuximab in gastric or gastroesophageal junction adenocarcinoma. N Engl J Med 2024; 391(12): 1159-62 17 Kwak Y et al.: Clinicopathologic and molecular characterization of stages II-IV gastric cancer with Claudin 18.2 expression. Oncologist 2025; 30(2): oyae238 18 Wainberg ZA et al.: Bemarituzumab as first-line treatment for locally advanced or metastatic gastric/gastroesophageal junction adenocarcinoma: final analysis of the randomized phase 2 FIGHT trial. Gastric Cancer 2024; 27(3): 558-70
Das könnte Sie auch interessieren:
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
ASH 2020 – Highlights zu den aggressiven Lymphomen
Highlight-Themen der virtuellen ASH-Jahrestagung im Dezember 2020 waren an erster Stelle die Immunonkologika in all ihren Variationen, aber auch Beispiele für innovative Sequenztherapien ...
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...