Seltene pulmonale Mykosen: Reisemitbringsel oder doch schon heimisch?
Autor:
Univ.-Prof. Dr. Helmut Salzer, MPH, FECMM
Klinische Abteilung für Infektiologie und Tropenmedizin
Universitätsklinikum für Innere Medizin 4 – Pneumologie
Kepler Universitätsklinikum, Linz
Medizinische Fakultät
Johannes Kepler Universität, Linz
Ignaz Semmelweis Institut, Wien
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Endemische systemische Mykosen werden überwiegend durch Schimmelpilze verursacht, die im menschlichen Organismus charakteristische Hefeformen annehmen. Klima- und Landnutzungswandel können die ökologischen Nischen verschieben, sodass Expositionen außerhalb der klassischen Endemiegebiete wahrscheinlicher werden.
Keypoints
-
Unter den endemischen Systemmykosen sind v.a. Histoplasma, Coccidioides, Blastomyces und Paracoccidioides von klinischer Bedeutung.
-
Bei Reiserückkehrer:innen mit Pneumonie ist eine detaillierte Reise- und Umweltanamnese für die weitere Diagnostik entscheidend.
-
Bei Verdachtsdiagnose ist die frühzeitige Information des Labors wichtig, damit spezifische Vorkehrungen getroffen werden können.
Endemische Systemmykosen werden überwiegend durch thermodimorphe Pilze verursacht, die in der Umwelt als Schimmel wachsen und im menschlichen Gewebe bei 37°C charakteristische Hefeformen annehmen. Klinisch relevant sind vor allem Histoplasma, Coccidioides, Blastomyces und Paracoccidioides. Daneben treten mit Talaromyces marneffei und den Kryptokokken opportunistische Systemmykosen auf, die besonders bei Patien-t:innen mit T-Zell-Defekten disseminieren und nicht selten die Lunge betreffen.
Außerhalb klassischer Endemiegebiete stellt eine sorgfältige Reise- und Expositionsanamnese den entscheidenden Hinweis zur Diagnose: Outdoor-Aktivitäten, der Besuch von Fledermaushöhlen oder Wüstenreisen in Endemiegebieten lenken die Aufmerksamkeit auf diese Infektionserkrankungen. Ebenso wichtig ist die frühzeitige Information des Labors, damit spezielle Färbungen, geeignete Nährmedien, verlängerte Bebrütungszeiten und Sicherheitsmaßnahmen (S3) veranlasst werden können. Die Nomenklatur befindet sich im Wandel, weil molekulare Untersuchungen fortlaufend neue Erkenntnisse liefern, die unser Verständnis verbessern. Neu hinzugekommen ist die Emergomykose als opportunistische, häufig pulmonal und kutan manifeste Infektion; histologisch ist sie von der Histoplasmose kaum zu trennen und die Epidemiologie ist noch nicht gut verstanden.
Histoplasmose
Die Histoplasmose (Histoplasma capsulatum) ist weltweit verbreitet und die häufigste dimorphe Mykose. In Nordamerika häufen sich Fälle im Mississippi- und Ohio-Tal; in Europa wird die Diagnose meist nach Reisen nach Lateinamerika, Südostasien oder Afrika gestellt.
Pathogenese und Klinik
Nach Inhalation kleiner infektiöser Partikel entstehen intrazelluläre Hefen, die sich in Makrophagen vermehren und früh hämatogen streuen können. Pulmonal zeigt sich häufig eine akute Pneumonie mit Fieber, trockenem Husten und retrosternalem Druckgefühl; bei hoher Exposition sind diffuse Infiltrate bis hin zu einem akuten Lungenversagen („acute respiratory distress syndrome“; ARDS) möglich. Heilt die Infektion nicht aus, entwickeln sich chronisch-pulmonale Formen mit einschmelzenden, teils kavernierenden Läsionen; mediastinale Entzündungsprozesse, Fibrosen und verkalkende Residuen sind typische Spätfolgen. In Residualkavernen besteht ein Langzeitrisiko für eine chronisch-pulmonale Aspergillose (CPA), was wiederum mit einer hohen Morbidität und Mortalität vergesellschaftet ist.
Diagnose und Therapie
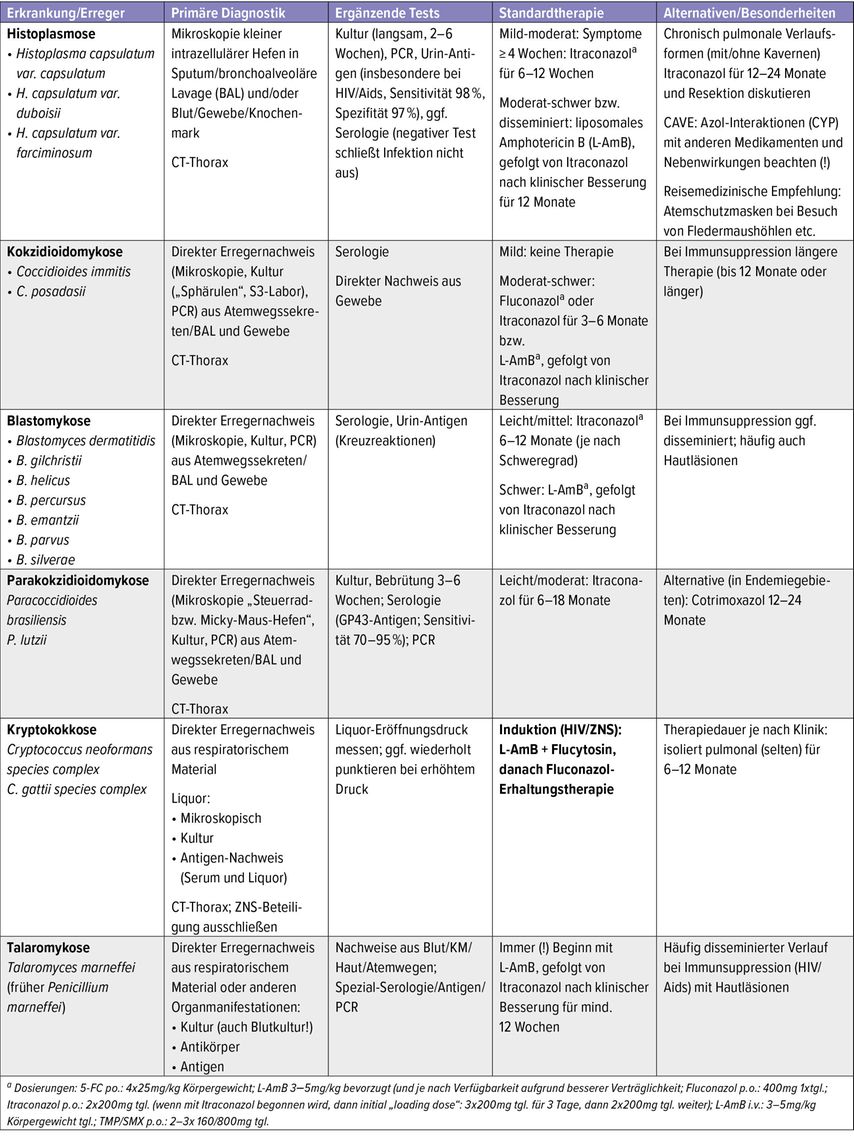
Diagnostisch stützen Mikroskopie kleiner intrazellulärer Hefen, Kultur (langsam), PCR und – besonders bei HIV/Aids – ein sensitiver Urin-Antigentest die Diagnose. Serologische Verfahren werden erst nach Wochen positiv und können kreuzreagieren (Tab.1).
Tab. 1: Übersicht über Diagnostik und Therapie endemischer systemischer Mykosen, die pulmonale Symptome hervorrufen können
Leichte akute Verläufe können beobachtet werden. Bei persistierenden Symptomen ist das Triazol Itraconazol Mittel der 1. Wahl (Tab.1). Chronisch-pulmonale Infektionen werden über 12–24 Monate mit Itraconazol behandelt. Bei moderaten bis schweren respiratorischen Infektionen erfolgt initial liposomales Amphotericin B (L-AmB) i.v. mit Step-down auf Itraconazol (cave: therapeutisches Drug-Monitoring und Medikamenten-Interaktionen [!] beachten). Disseminierte Verläufe erhalten L-AmB mit anschließender Itraconazol-Erhaltungstherapie, Zweitere für insgesamt etwa 12 Monate. Eine chirurgische Resektion residueller Kavernen kann zur CPA-Prävention sinnvoll sein.
Kokzidioidomykose
Die Kokzidioidomykose (Coccidioides immitis) ist in den Trockengebieten des amerikanischen Südwestens, in Mexiko und Teilen Südamerikas endemisch.
Pathogenese und Klinik
Staubaufwirbelung und Extremwetterereignisse begünstigen Ausbrüche. Nach Inhalation von Konidien bilden sich im Gewebe Sphärulen mit zahlreichen Endosporen, die bei Ruptur die Infektion ausdehnen. Klinisch dominiert eine subakute Pneumonie mit Krankheitsgefühl, Fieber, Husten und Arthralgien. Häufig manifestiert sich auch ein Erythema nodosum. Pulmonal können dünnwandige Kavernen und Pleurabeteiligungen auftreten; häufig bleiben kalzifizierende Restknoten zurück. Eine Dissemination (≈1%) betrifft bevorzugt ZNS, Knochen und Haut und ist wahrscheinlicher bei Immunsuppression.
Diagnose und Therapie
Die Diagnostik gelingt in aller Regel mikroskopisch durch den Nachweis von Sphärulen in Sputum oder bronchoalveolärer Lavage (BAL; Tab.1). Die Kultur ist möglich, aber wegen hochinfektiöser Konidien ist ein S3-Labor erforderlich. PCR und Serologie können die Diagnose unterstützen. Bei neurologischen Symptomen ist eine Lumbalpunktion obligat. Unkomplizierte Pneumonien oder kleine Kavernen können beobachtet werden, bei Progression oder Risikokonstellation wird Fluconazol oder Itraconazol eingesetzt. Eine Meningitis erfordert ZNS-gängige Azole in hoher Dosierung mit Spiegelkontrolle, chirurgische Interventionen sind Einzelfallentscheidungen.
Blastomykose
Die Blastomykose (Blastomyces dermatitidis) ist in Nordamerika (Große Seen, Ohio-/Mississippi-Tal; USA) heimisch. Aus Afrika, dem Nahen Osten und Indien werden Fälle mit zusätzlichen Spezies berichtet.
Pathogenese und Klinik
Nach Inhalation wandeln sich die Sporen in Hefen mit ausgeprägter Immunevasion um. Das Spektrum reicht pulmonal von akuter bis chronischer Pneumonie mit Hämoptysen bis hin zu fulminantem ARDS. Bei einem beträchtlichen Teil der Patient:innen (25–40%) treten extrapulmonale Herde in Haut, Knochen, Urogenitaltrakt oder ZNS auf, besonders bei Immunsuppression.
Diagnose und Therapie
Mikroskopisch ist die breitbasige Sprossung richtungsweisend, allerdings existiert morphologische Variabilität. Kultur (meist 5–14 Tage) und ggf. PCR sichern die Diagnose (Tab.1). Ein Urin-Antigen-Test ist sensitiv, kann jedoch mit Histoplasma kreuzreagieren. Therapeutisch sollten die Patient:innen wie folgt behandelt werden: Leichte und mittelschwere Verläufe sprechen auf Itraconazol an, schwere oder disseminierte Infektionen erfordern initial L-AmB i.v. mit anschließender oraler Azoltherapie.
Parakokzidioidomykose
Die Parakokzidioidomykose (Paracoccidioides brasiliensis) ist in Südamerika endemisch, vier Fünftel der Fälle entfallen auf Brasilien. Reaktivierungen Jahrzehnte nach Erstexposition sind möglich.
Pathogenese und Klinik
Die chronische, adulte Form manifestiert sich vorrangig pulmonal mit Husten, Thoraxschmerzen und radiologisch oft stärker ausgeprägten Infiltraten, als klinisch zu erwarten wäre. Die akute/juvenile Form zeigt systemische Befallsmuster mit Lymphadenopathie, Hepato-/Splenomegalie und Knochenmarkbeteiligung. Mukosa- und Hautläsionen – etwa die „Mulberry-like“-Stomatitis – sind beschrieben. Unbehandelt drohen Lungenfibrose, narbige Veränderungen der oberen Atemwege und eine Nebenniereninsuffizienz.
Diagnose und Therapie
Diagnostisch sind große, multipolar sprossende Hefen („Steuerrad/Micky Mouse“) in Atemwegssekreten oder Biopsien charakteristisch; die Kultur benötigt 3–6 Wochen. Serologien gegen GP43 sind für P. brasiliensis sensitiv, bei P. lutzii jedoch eingeschränkt, molekulare Nachweise stehen in spezialisierten Laboren zur Verfügung. Behandelt wird in der Regel mit Itraconazol über 6–18 Monate. In Endemiegebieten kommen lang dauernde Cotrimoxazol-Regime zum Einsatz (Tab.1).
Kryptokokkose
Die Kryptokokkose ist die häufigste Pilzinfektion des ZNS; Cryptococcus neoformans dominiert weltweit, während C. gattii häufiger pulmonale Verläufe auch bei immunkompetenten Personen verursacht.
Pathogenese und Klinik
Pulmonal reicht das Spektrum von solitären Noduli bis zu bilateralen Infiltraten; wegen der hohen Neigung zur ZNS-Streuung muss eine ZNS-Beteiligung konsequent ausgeschlossen werden.
Diagnose und Therapie
Bei klinischem Verdacht sind Bildgebung und die Messung des Liquoreröffnungsdrucks zentral (Tab.1). Mikroskopie (Tusche), Kultur und der sehr sensitive Antigennachweis in Serum und Liquor sichern die Diagnose. Höhere Antigentiter sind prognostisch ungünstig.
ZNS- oder disseminierte Infektionen – insbesondere bei HIV/Aids – werden mit L-AmB plus 5-Flucytosin für etwa zwei Wochen behandelt, gefolgt von Fluconazol zur Konsolidierung und Erhaltung (Gesamtdauer in der Regel ≥12 Monate; Suppression bis zur CD4-Erholung). Ein erhöhter intrakranieller Druck erfordert wiederholte Liquorentlastungen oder Drainage. Unkomplizierte pulmonale Verläufe können nach sicherem Ausschluss einer ZNS-Beteiligung unter Fluconazol therapiert werden (Tab.1).
Talaromykose
Die Talaromykose (Talaromyces marneffei) ist in Südostasien und Südchina verbreitet und zählt dort zu den häufigsten Aids-Manifestationen.
Pathogenese und Klinik
Pulmonal finden sich endobronchiale Läsionen, noduläre oder alveoläre Infiltrate und gelegentlich Kavernen. Charakteristisch – wenn auch nicht obligat – sind papulöse Hautläsionen mit zentraler Nekrose.
Diagnose und Therapie
Diagnostisch fallen in der Mikroskopie kleine intrazelluläre Hefen mit Längsteilung auf, in der Kultur zeigt der Erreger sein dimorphes Wachstum (Schimmel bei 25°C, oft mit rotem Pigment; Hefe bei 37°C). Nachweise gelingen aus Blut, Knochenmark, Haut und Atemwegen, serologische und antigenbasierte Tests sowie PCR sind Spezialverfahren (Tab.1). Die Therapie ist zweistufig aufgebaut: L-AmB über zwei Wochen, anschließend Itraconazol zur Rezidivprophylaxe.
Einfluss von Klimawandel und Naturkatastrophen
Zunehmende Dürrephasen, Staubstürmeund Extremwetterereignisse erleichtern dieAerosolisation bodenbewohnender Pilze und wurden in hochwertigen Studien mit steigenden Fallzahlen der Kokzidioidomykose verknüpft. Erwärmung und Landnutzungswandel können die ökologischen Nischen dimorpher Pilze verschieben, sodass Expositionen außerhalb klassischer Endemiegebiete wahrscheinlicher werden. Für die Praxis bedeutet das: Bei Reiserückkehrer:innen mit Pneumonie ist eine detaillierte Reise- und Umweltanamnese entscheidend, um eine gezielte Diagnostik auf endemische Mykosen einleiten zu können.
Literatur:
beim Verfasser
Das könnte Sie auch interessieren:
Lorem ipsum dolor sit amet
Lorem ipsum dolor sit amet, consetetur sadipscing elitr, sed diam nonumyeirmod tempor invidunt ut labore et dolore magna aliquyam erat, sed diam voluptua.At vero eos et accusam et justo ...