
17. August 2020
Lungenkarzinom
Behandlungs- und Schnittstellenmanagement
In Österreich ist Krebs die zweithäufigste Todesursache, doch wenn die Entwicklung hier so verläuft wie in anderen Ländern, dann wird er bald zur Todesursache Nummer eins.1 Das Lungenkarzinom ist mit mehr als 4700 Fällen die zweithäufigste Krebsart hierzulande. Allerdings ist es mit 3900 Todesfällen die häufigste Krebstodesursache.1 Dank moderner Therapien haben sich die Überlebenschancen der Patienten jedoch deutlich verbessert.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf allgemeineplus.at und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. universimed.com & med-Diplom.at)
Rauchen ist nach wie vor der wichtigste Risikofaktor für das Lungenkarzinom. Etwa 85 bis 90% der Fälle sind tabakassoziiert. Daher ist die wichtigste Prophylaxe der Rauchstopp. Dies gilt auch für ältere und langjährige Raucher, denn es ist nie zu spät, um aufzuhören. Jede Zigarette, die nicht geraucht wird, verringert das Krebsrisiko.2 Wie viel jemand raucht, spielt dabei keine Rolle. Das Gleiche gilt für sogenannte Leichtzigaretten. Bei diesen wird in der Regel tiefer inhaliert, die krebserregenden Stoffe gelangen so auch in die Peripherie. Das zeigt sich deutlich an der Art der Karzinome. Während man früher, als noch vermehrt starke Zigaretten geraucht wurden, eher Plattenepithelkarzinome sah, die zentral entstehen, findet man heute vor allem Adenokarzinome in der Peripherie.3
Noch 2016 stand Österreich beim Nichtraucherschutz in Europa an letzter Stelle.4 Durch die mittlerweile in Kraft getretenen Gesetze zur Tabakkontrolle nahm Österreich 2019 einen Platz im Mittelfeld ein. Obwohl es ein erfreuliches Zeichen ist, bleibt noch viel zu tun.
Screening – ja oder nein?
Mehr als die Hälfte der Lungenkarzinome wird erst im fortgeschrittenen Stadium IV diagnostiziert, nur etwa ein Viertel der Patienten befindet sich in einem frühen Stadium (I–II), in dem ein kurativer Therapieansatz möglich ist.5 Dies führt immer wieder zur Diskussion, ob ein Screening sinnvoll sein könnte. Regelmäßiges Thoraxröntgen, Sputumanalysen und das Bestimmen von Tumormarkern sind jedoch nicht sinnvoll, solange keine Symptome vorliegen. Gute Daten gibt es allerdings zum Screening mit der sogenannten Low-Dose-Computertomografie. Wie eine aktuelle Studie gezeigt hat, kann so die Lungenkrebssterblichkeit über einen Zeitraum von zehn Jahren um 24% gesenkt werden. In dieser Untersuchung wurden Personen über 50 Jahre gescreent, die 30 Jahre täglich mindestens 10 Zigaretten oder 25 Jahre mindestens 15 Zigaretten geraucht hatten. Ein Rauchstopp sollte nicht länger als 10 Jahre zurückgelegen haben. Sie wurden am Tag 0 sowie nach einem, drei und fünfeinhalb Jahren untersucht.6
Würde man diese Kriterien in Österreich anwenden, dann müssten 350000 Personen untersucht werden, allein in Wien wären es 75000 Personen. Da dies die vorhandenen Kapazitäten sprengen würde, ist es wichtig, eine Risikogruppe zu definieren, die von einem Screening profitiert, um unnötige Untersuchungen zu vermeiden. Darüber hinaus muss geklärt werden, wie viele Untersuchungen in welchen Intervallen sinnvoll sind. Zu bedenken ist auch, wie mit verdächtigen Befunden umzugehen ist. Oftmals stellt sich ein in der CT gefundener Rundherd als harmlos heraus. Für den Patienten bedeutet es aber eine weiterführende invasive Diagnostik und eine psychische Belastung.
Diagnose und Therapie
Die Diagnose eines Bronchialkarzinoms erfolgt in der Regel mittels Bronchoskopie inklusive Probenentnahme.
In der Behandlung des Lungenkarzinoms wurden seit den 1990er-Jahren enorme Fortschritte erzielt. Die Überlebenszeit konnte verdoppelt oder gar verdreifacht werden. Für die Wahl der Therapie sind verschiedene Faktoren entscheidend. Einerseits tumorbedingte, zum Beispiel, ob es sich um ein Adenokarzinom oder ein Non-Adenokarzinom handelt und ob bestimmte Biomarker nachweisbar sind. Dazu zählen unter anderem PD-L1, EGFR, EML4-ALK, ROS1, BRAF, MET und RET. Andererseits spielen patientenbedingte Faktoren eine Rolle, beispielsweise eventuelle Komorbiditäten (kardiovaskuläre Krankheiten, COPD, Niereninsuffizienz) und der allgemeine Gesundheitsstatus (Performancestatus nach ECOG oder Karnovsky). Das tatsächliche Alter des Patienten ist dabei von untergeordneter Bedeutung. Wichtiger ist das „biologische Alter“: Ein 30-Jähriger kann schon erhebliche Komorbiditäten aufweisen, die eine Therapie einschränken, während ein fitter 90-Jähriger die komplette Therapie erhalten kann.
Wegen der Komplexität ist es ratsam, den Patienten an ein spezialisiertes Zentrum zu überweisen. Dort werden die Patientenfälle in einem Tumorboard vorgestellt, das sich aus Experten unterschiedlicher Fachrichtungen zusammensetzt, beim Lungenkrebs zum Beispiel aus Pneumologen, Onkologen, Radiologen, Thoraxchirurgen und Strahlentherapeuten. Je nach Befund stehen therapeutisch zur Verfügung:
Resektion (Segment, Lobektomie, Pneumonektomie)
Systemische Therapien (Chemotherapie, Immuntherapie, zielgerichtete Therapie)
Strahlentherapie (kurativ, ± CT, prophylaktisch, palliativ)
Best Supportive Care (BSC), die bestmögliche Symptomkontrolle, die alle Patienten erhalten sollten
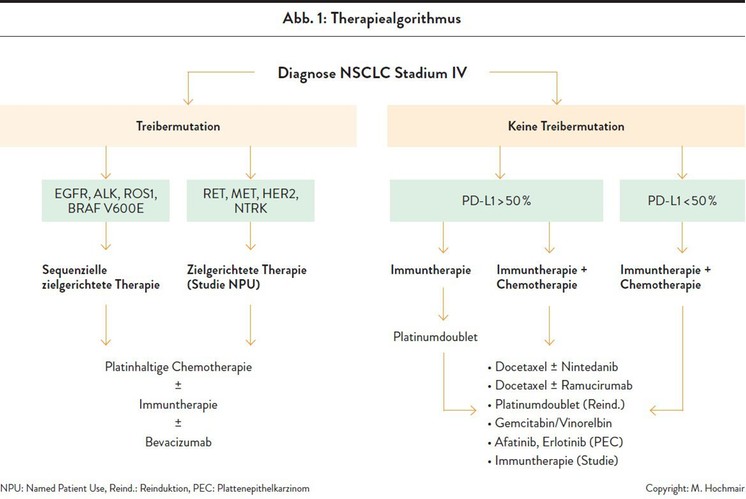
Abbildung 1 zeigt die verschiedenen Möglichkeiten zugelassener Therapien für das nicht kleinzellige Lungenkarzinom (NSCLC) im Stadium IV, das den Großteil der Lungenkarzinome ausmacht.7
Bei etwa einem Drittel der Patienten wird eine sogenannte Treibermutation wie EGFR, ALK, ROS1 oder HER2 gefunden. In diesen Fällen wird eine zielgerichtete Therapie sequenziell eingesetzt. Vielen Patienten kann so für eine lange Zeit eine Chemotherapie erspart werden. Der Vorteil ist, dass diese Medikamente sehr gut verträglich sind und die Patienten lange Zeit ein normales Leben führen können. Liegen keine Treibermutationen vor, erhält der Patient entweder eine Immun- oder eine Immunchemotherapie, wobei die Chemotherapie nur noch ein Zusatz ist.
Immuntherapie
Üblicherweise erkennt das Immunsystem Tumorzellen, da diese bestimmte Antigene freisetzen, die zur Aktivierung von T-Zellen führen. Die aktivierten T-Zellen zerstören den Tumor. Dieses System kann aber durch verschiedene Einflüsse, unter anderem das Rauchen, blockiert sein, wodurch sich Tumorzellen ungehindert vermehren können. Mithilfe der Immuntherapie kann die Blockade überwunden werden. Wichtige Vertreter sind die PD1/PD-L1-Inhibitoren. PD1 und PD-L1 sind inhibierende Rezeptoren auf der Tumoroberfläche, die die Aktivierung des Immunsystems hemmen. Werden diese Rezeptoren durch die PD1/PD-L1-Inhibitoren blockiert, kann das Immunsystem aktiviert und der Tumor vernichtet werden.
Die ersten Substanzen wurden in Studien zur Zweitlinientherapie nach Chemo- oder zielgerichteter Therapie eingesetzt und mit einer Chemotherapie verglichen. Es zeigte sich, dass Patienten mit einer hohen PD-L1-Expression (≥1%) ein deutlich verlängertes Gesamtüberleben hatten.8 Daraufhin wurden PD-L1-Inhibitoren auch in der Erstlinientherapie untersucht, wo sie erneut mit einem deutlich verlängerten Gesamtüberleben verbunden waren.9
Zu beachten ist, dass diese Medikamente andere Nebenwirkungen verursachen als die klassische Chemotherapie. Es treten vermehrt autoimmunbedingte Wirkungen, unter anderem auf die Haut, den Gastrointestinaltrakt, die Leber und die Schilddrüse, auf. Auch Lungenentzündungen können vorkommen.9 Deshalb bekommt der Patient in der Regel einen Pass, in dem festgehalten ist, welche Immuntherapie er erhält und welche Nebenwirkungen auftreten können. Das beste Gegenmittel ist systemisch verabreichtes Kortison, selbst bei einer Pneumonitis. Am besten sollte ein niedergelassener Arzt, der einen Patienten unter Immuntherapie betreut, bei Nebenwirkungen das spezialisierte Zentrum kontaktieren, das die Behandlung eingeleitet hat.
Zielgerichtete Therapie
Diese Therapien werden, wie der Name schon sagt, gezielt auf ganz bestimmte Patientengruppen ausgerichtet. Entscheidend ist dabei der Nachweis einer sogenannten Treibermutation wie EGFR, ALK, BRAF, MET, RET, HER2 etc. Im Vergleich zu einer Chemotherapie können zielgerichtete Therapien das Überleben der Patienten deutlich verlängern.10 Daher ist es essenziell, auf solche Mutationen zu testen und die Patienten bereits in der ersten Linie mit den entsprechenden Substanzen zu behandeln. Eine Immuntherapie hat in diesen Fällen nicht den gleichen positiven Effekt. Dies gilt auch bei Hirnmetastasen, da die zielgerichteten Medikamente eine hohe Wirksamkeit im Gehirn aufweisen.11
Die Therapien sind insgesamt besser verträglich als eine Chemotherapie. Hauptsächliche Nebenwirkungen sind Durchfall, Hautausschläge und Entzündungen der Mundschleimhaut und des Nagelbetts.12
Therapie der Zukunft
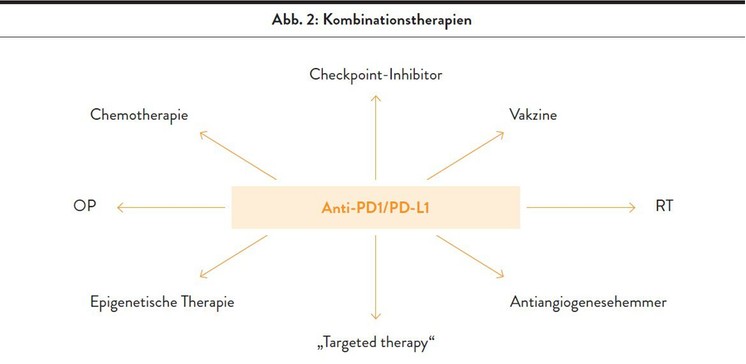
Zunehmend befassen sich klinische Studien mit Kombinationen verschiedener Therapieverfahren. Daher wird es in Zukunft eine Vielfalt unterschiedlicher Kombinationen für die Behandlung des Lungenkarzinoms geben (Abb. 2).
Bericht:
Dr. Corina Ringsell
Quelle:
Vortrag von OA Dr. Maximilian Hochmair im Rahmen des virtuell abgehaltenen ALLGEMEINE+ Sommerquartetts 2020 vom 20.Juni 2020
Literatur:
Statistik Austria 2017
Vineis P et al.: J Natl Cancer Inst 2004; 96: 99-106
Wahbah M et al.: Ann Diagn Pathol 2007; 11: 89-96
Joossens L et al.: www.tobaccocontrolscale.org
Mountain C et al.: Chest 1997; 111: 1710-7
de Koning HJ et al.: N Engl J Med 2020; 382: 503-13
Hochmair M: SOP-Klinik Floridsdorf, Stand 2019
Horn L: ESMO Congress 2015, Abstr. 1227
Brahmer JR et al.: World Conference on Lung Cancer 2017, Abstr. OA 17.06
Yang JCH et al.: J Clin Oncol 2014; 32(Suppl): 8004
Filipits M et al.: ESMO Asia 2019, Abstr. 458P
Park K et al.: ESMO Asia 2015, Abstr. LBA2 PR
