DFP-Literaturstudium
Tipps für die Praxis - Herzinsuffizienz im Alltag
Die Herzinsuffizienz ist epidemiologisch bedeutsam: Ab einem Alter von 70 Jahren ist bereits jeder Zehnte davon betroffen. In Österreich leiden etwa 300 000 Menschen an einer Herzinsuffizienz und sie verursacht jedes Jahr rund 27 000 Krankenhausaufnahmen. Daher ist es auch für Allgemeinmediziner wichtig, sich mit dem Thema auseinanderzusetzen.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf allgemeineplus.at und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. universimed.com & med-Diplom.at)
Die Inzidenz der Herzinsuffizienz nimmt zu – dies zeigt zum Beispiel ein Blick auf die Krankenhausentlassungsdiagnosen: Die Diagnose „Herzinsuffizienz“ hat sich in den vergangenen 30 Jahren verdreifacht. Dafür gibt es mehrere Gründe und paradoxerweise ist die immer bessere medizinische Versorgung einer davon. So hat etwa durch die verbesserte Akutmedizin die Herzinfarktsterblichkeit von 2002 bis 2011 um rund 5 % jährlich abgenommen.1 Die Zunahme der Herzinsuffizienz ist, so paradox das auch klingen mag, auch ein Beleg für die positiven Entwicklungen der Herzmedizin in anderen Bereichen. Viele Patienten überleben andere akute aber auch chronische Herzerkrankungen, leben deshalb entsprechend länger, und entwickeln in einer späteren Lebensphase eine Herzinsuffizienz.2 In den westlichen Industriestaaten sind die häufigsten Ursachen der chronischen Herzinsuffizienz KHK mit 54 bis 70 % und Bluthochdruck, wobei es hier große Überschneidungen gibt. Weitere Ursachen bzw. Risikofaktoren sind Diabetes mellitus, Herzrhythmusstörungen, vor allem atriale Tachyarrhythmien, und Funktionsstörungen der Herzklappen. Einer zunehmenden Herzschwäche können aber auch Entzündungen des Myokards oder Perikards vorausgehen; Stoffwechselstörungen wie eine Hyperthyreose, kardiotoxische Medikamente (z. B. Chemotherapeutika), Speicherkrankheiten wie Amyloidose, Alkohol- oder Drogenmissbrauch sind ebenfalls potenzielle Auslöser; in seltenen Fällen können auch genetische Ursachen oder andere Erkrankungen wie etwa eine Sarkoidose eine Herzschwäche hervorrufen.
Symptome und Diagnose
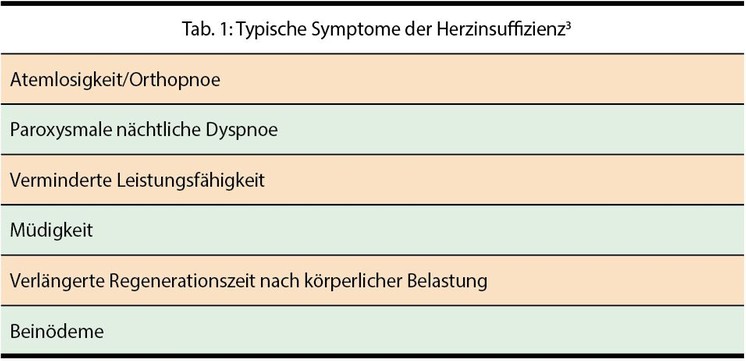
Der Hausarzt sollte immer hellhörig werden, wenn ein Patient über eine zunehmende Atemnot und verminderte Leistungsfähigkeit klagt. Bei älteren Patienten sollte gezielt nach den typischen Beschwerden einer Herzinsuffizienz (Tab. 1) gefragt werden. Denn gerade ältere Menschen glauben fälschlicherweise, diese Symptome im Rahmen eines natürlichen Alterungsprozesses zu erleiden. Zudem entwickelt sich eine Herzinsuffizienz meist schleichend, und je langsamer dies geschieht, desto geringer ist auch die subjektive Wahrnehmung vonseiten des Patienten. Die Basis für die Diagnosestellung ist eine sorgfältige Anamnese (Abb. 1). Abgeklärt werden dabei Vorerkrankungen wie KHK, Hypertonie, Diabetes sowie weitere Risikofaktoren, zum Beispiel Adipositas oder Nikotinabusus. Dem folgt eine gründliche körperliche Untersuchung mit Auskultation des Herzens und der Lunge. Auch das EKG kann Hinweise auf eine Störung der Reizleitung oder Rhythmusstörungen zeigen. Seit vielen Jahren gibt es außerdem Parameter, die laborchemisch ermittelt werden können: die natriuretischen Peptidhormone NT-proBNP und BNP, vasodilatatorische Botenstoffe, die durch erhöhte Diurese und Natiurese das Plasmavolumen senken. Sind diese Werte erhöht, kann dies ein Hinweis auf eine Herzschwäche sein. Ein ausführlicher Laborbefund mit Blutbild, Leber- und Nierenwerten, Elektrolytanalyse, Entzündungswerten, Eiweiß und Albumin sowie eine Nativharnanalyse sind zur Differenzialdiagnose anderer Ursachen einer Atemnot oder von Beinödemen/Wassereinlagerungen erforderlich.3 Das Röntgen der Lunge ist hilfreich, um beispielsweise Pleuraergüsse oder perihiläre Stauungszeichen zu erkennen.3 Zudem wird eine Echokardiografie empfohlen, um zu beweisen, dass die Beschwerden tatsächlich eine kardiale Ursache haben, und um weitere Hinweise auf die Ätiologie zu bekommen.3
aPatient berichtet Herzinsuffizienz-typische Symptome (Tab. 1)
bNormale Ventrikel- und Vorhofvolumina und -funktion
cAndere Ursachen für erhöhte natriuretische Peptide in Betracht ziehen
Einteilung und Therapie
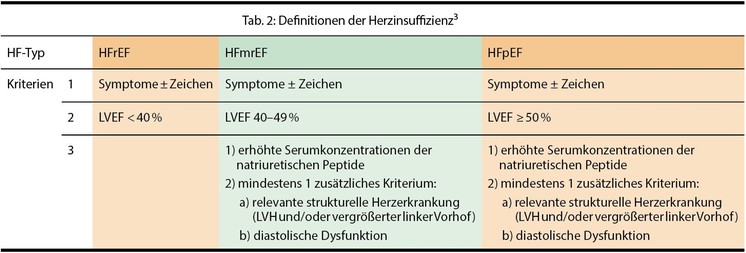
Eine Herzinsuffizienz zeichnet sich durch das Unvermögen des Herzens aus, Gewebe und Organe ausreichend mit Blut und Sauerstoff zu versorgen. Dies kann sowohl durch eine Störung der Füllungsphase als auch der Austreibungsphase des Herzens bedingt sein. Je nach dem klinischen Schweregrad (Einschränkungen wegen Dyspnoe, Fatigue, Palpitationen) wird die Herzinsuffizienz eingeteilt in NYHA-Klasse I (asymptomatisch), II (leichte Einschränkung der körperlichen Leistungsfähigkeit; keine Beschwerden in Ruhe und bei geringer Anstrengung), III (höhergradige Einschränkung der körperlichen Leistungsfähigkeit bei gewohnter Tätigkeit, z. B. Gehen in der Ebene; keine Beschwerden in Ruhe) oder IV (Beschwerden bei allen körperlichen Aktivitäten und/oder in Ruhe).4 Früher unterschied man zwischen einer systolischen und einer diastolischen Herzinsuffizienz. Mittlerweile ist man davon abgekommen, da es keine klare Trennlinie gibt und meist systolische und diastolische Dysfunktionen gemeinsam vorliegen, sodass man sich in der Unterscheidung auf die linksventrikulären Ejektionsfraktion (LVEF) reduziert hat. Abhängig von der LVEF werden die Patienten in drei Gruppen eingeteilt:
in solche mit Herzinsuffizienz mit erhaltener (HFpEF; LVEF ≥ 50 %),
Patienten mit „mid range ejection fraction“ (HFmrEF) – das heißt, die linksventrikuläre Ejektionsfraktion beträgt 40-49 % – und
Patienten mit reduzierter Ejektionsfraktion (HFrEF; LVEF < 40 %).
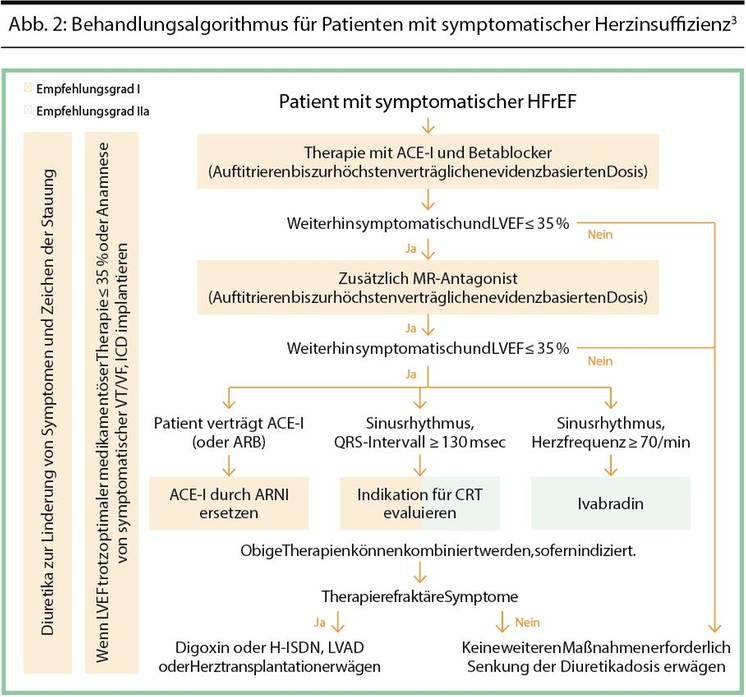
Tabelle 2 zeigt, welche Kriterien dafür herangezogen werden.3 Für die HFmrEF und HFpEF gibt es keine durch klinische Studien belegten speziellen Therapien. Bei dieser Patientengruppe sollen die Komorbiditäten optimal behandelt werden, wie etwa Hypertonie oder Diabetes mellitus. Für Patienten mit HFrEF stehen dagegen zahlreiche Medikamente und Behandlungsverfahren zur Verfügung (Abb. 2).3
ACE-I: Angiotensin-Converting-Enzym-Hemmer; ARB: Angiotensin-Rezeptorblocker; ARNI: Angiotensin-Rezeptor-Neprilysin-Hemmer; CRT: kardiale Resynchronisationstherapie; H-ISDN: Hydralazin-Isosorbiddinitrat; ICD: implantierbarer Kardioverter/Defibrillator; LVAD: linksventrikuläres Unterstützungssystem; MR: Mineralokortikoid-Rezeptor; VF: Kammerflimmern; VT: Kammertachykardie
Medikamentöse Therapie der HFrEF: Start low – go slow
Bei der medikamentösen Therapie ist es grundsätzlich wichtig, mit einer niedrigen Startdosis zu beginnen und diese langsam zu steigern, bis die jeweilige Zieldosierung erreicht ist. Studien haben gezeigt, dass höhere Dosierungen die Ereignisraten durch Herzinsuffizienz (v. a. Hospitalisierungen) senken.
Die Erstlinientherapie besteht aus einem ACE-Inhibitor und einem Betablocker. ACE-Hemmer und Betablocker wirken komplementär, reduzieren Morbidität und Mortalität, und sollten deshalb möglichst parallel begonnen und auftitriert werden, sobald die Diagnose HFrEF gestellt wurde.3
ACE-Inhibitoren können ab einem systolischen Blutdruck von 90 mmHg, einer eGFR von 30 ml/min/1,73m2 und Normokaliämie gegeben und gesteigert werden. Das Serumkalium sollte dabei nicht über 5,5 mmol/L steigen. Bei Unverträglichkeit kann auf einen Angiotensin-1-Rezeptorblocker ausgewichen werden. Die Patienten müssen regelmäßig zu Kontrolluntersuchungen einbestellt werden, um vor allem Blutdruck, Nierenparameter und Elektrolyte zu überprüfen. Bei einem Blutdruck < 90 mmHg und einer eGFR von 30 ml/min sollte die Therapie nicht begonnen werden.3
Betablocker können bei einem systolischen Blutdruck von 90 mmHg und einer Herzfrequenz von 50/min gegeben und gesteigert werden. Ziel ist die Blockade des hochregulierten sympathikoadrenergen Systems. Auf Nebenwirkungen wie Bradykardie und Hypotonie ist zu achten. Der Anteil der Betablockade an den Potenzstörungen bei männlichen HI-Patienten ist noch unklar. Beachten sollte man auch, dass die Symptome sich zu Beginn der Therapie verschlechtern können – daher ist es wichtig, die Dosis langsam zu steigern. Eventuell kann es helfen, bei vermehrten Hypervolämieanzeichen die Diuretikadosis kurzfristig zu erhöhen. Bei akut dekompensierten Patienten sollten keine Betablocker neu eingesetzt oder deren Dosis gesteigert werden.
Ein weiterer fester Bestandteil der Therapie sind Mineralokortikoid-Rezeptorantagonisten, wobei Spironolacton und Eplerenon zur Verfügung stehen. Sollte es durch die Verabreichung von Spironolacton zu Nebenwirkungen wie Gynäkomastie kommen, kann auf Eplerenon gewechselt werden. Ein Monitoring der Nierenwerte und Elektrolyte (vor allem Kalium) ist unter dieser Therapie essenziell.3
Als Ergänzung zum Betablocker kann Ivabradin eingesetzt werden. Ein Beginn der Therapie ist indiziert bei einer Auswurffraktion ≤ 35 % und bestehendem Sinusrhythmus mit einer Herzfrequenz ≥ 70/min.3
Eine der neuen Wirkstoffklassen in der Gruppe der Herzinsuffizienzmedikamente sind Angiotensin-Rezeptor-Neprilysin-Inhibitoren (ARNI). Die Kombination blockiert einerseits das Renin-Angiotensin-Aldosteron- System, die zusätzliche Inhibition von Neprilysin führt zu einem erhöhten Spiegel der natriuretischen Peptide, die neben Natriurese und Vasodilatation auch andere positive Eigenschaften wie antifibrotische, und antihypertrophe Effekte haben.3 In einer großen randomisierten, kontrollierten Studie (PARADIGM-HF) mit mehr als 8400 Patienten mit Herzinsuffizienz der NYHA-Klassen II–IV und einer Ejektionsfraktion von maximal 40 % wurde der ARNI Valsartan/Sacubitril gegen Enalapril getestet und erzielte signifikant bessere Resultate als Enalapril.5
Geeignet sind ARNI für Patienten der NYHA- Klassen II–IV, die trotz Standardtherapie symptomatisch sind und eine reduzierte LVEF (EF ≤ 35 %) aufweisen. Bei Patienten, die von einem ACE-Hemmer auf einen ARNI umgestellt werden, muss der ACE-Hemmer 36 Stunden vor der ARNI-Gabe abgesetzt werden. Bei Angiotensin- Rezeptorblockern ist eine sofortige Umstellung möglich.3
Schleifendiuretika haben keinen nachgewiesenen prognostischen Vorteil bei Herzinsuffizienz. Sie dienen deshalb ausschließlich dem Erreichen und Erhalt der Euvolämie und sollten auch reduziert oder gar abgesetzt werden, wenn nach Optimierung der Herzinsuffizienztherapie keine Neigung zur Flüssigkeitsretention mehr besteht. Im Rahmen einer aktuellen Metaanalyse von 19 Studien mit mehr als 19 000 Patienten wurden zwei Schleifendiuretika, nämlich Furosemid und Torasemid gegenübergestellt, wobei Torasemid günstige Effekte gezeigt hat. Mit Torasemid kam es zu einer deutlicheren Verbesserung der NYHA-Klasse und es zeigte sich ein Trend zur Reduktion der Hospitalisierungsrate. Anders als Furosemid muss Torasemid nur einmal täglich eingenommen werden. Da es zu 90 % über die Leber abgebaut wird, ist es auch für Patienten mit eingeschränkter Nierenfunktion gut geeignet.6
Den behandelnden Ärzten steht also eine Vielzahl an Medikamenten zur Verfügung. Leider hat jedoch eine Studie des Hauptverbands der österreichischen Sozialversicherungsträger gezeigt, dass nur etwa jeder zweite Patient mit Herzinsuffizienz seine Medikamente auch tatsächlich wie verordnet einnimmt. Ausgewertet wurden die Daten von 37 000 Patienten mit Herzinsuffizienz. Die Ergebnisse zeigten auch, dass Patienten, die regelmäßige Arztkontakte und eine hohe Therapietreue aufwiesen, ein signifikant längeres Überleben hatten als Patienten mit schlechter Therapieadhärenz.7 Für die Hausärzte ist es daher wichtig, die Patienten regelmäßig zu Kontrolluntersuchungen zu bestellen und die Therapie zu überprüfen.
Implantierbare Devices
Bei Patienten mit Herzinsuffizienz NYHA II-IV, einer Ejektionsfraktion ≤ 35 % und einer QRS-Breite von mindestens 130 ms im EKG wird die Implantation einer kardialen Resynchronisationstherapie (CRT) empfohlen.3 Diese Therapie kann die Herzleistung bei entsprechend ausgewählten Personen verbessern und die Morbidität als auch Mortalität verringern. Das Ausmaß des sogenannten „reverse remodelling“ ist einer der wichtigsten CRT-Mechanismen: Leider ist deshalb bei Patienten mit myokardialem Narbengewebe eine weniger ausgeprägte Besserung der LV-Funktion zu erwarten. Bildgebende Tests auf Dyssynchronie haben bisher noch keinen Nutzen für die Auswahl von Patienten für eine CRT gezeigt. Bei fortgeschrittener Herzschwäche trotz optimierter Therapie sollten die Patienten an einem Herztransplantationszentrum vorgestellt werden. Bei manchen Kontraindikationen zur Transplantation oder als Überbrückungsmaßnahme bei langer Wartedauer auf ein Spenderorgan kann ein Ventricular Assist Device indiziert sein.
Bericht:
Dr. Corina Ringsell, Dr. Katrin Spiesberger
Literatur
Griebler R et al.: Herz-Kreislauf-Erkrankungen in Österreich: Angina Pectoris, Myokardinfarkt, ischämischer Schlaganfall, periphere arterielle Verschlusskrankheit. Epidemiologie und Prävention. BMG 2014; ISBN: 978-3-85159-191-0
Pressetext der Deutschen Gesellschaft für Kardiologie - Herz- und Kresilaufforschung e.V., 25. Jänner 2017
Ponikowski P et al.: ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J 2016; 37: 2129-200
The Criteria Committee of the New York Heart Association (NYHA): Nomenclature and criteria for diagnosis of diseases of the heart and great vessels. 9th ed. Boston: Little & Brown, 1994
McMurray JJV et al.: Angiotensin-neprilysin inhibition versus enalapril in heart failure. N Engl J Med 2014; 371: 993-1004
Abraham B et al.: Meta-analysis comparing torsemide versus furosemide in patients with heart failure. Am J Cardiol 2020; 125: 92-9
Presseaussendung des Hauptverbands der österreichischen Sozialversicherungsträger, 19. März 2013