27. Mai 2021
Roboterchirurgie in der Hüftendoprothetik: ein aktueller Trend oder die Zukunft?
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf allgemeineplus.at und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. universimed.com & med-Diplom.at)
Die „Operation des Jahrhunderts“: Die elektive Implantation einer Hüfttotalendoprothese gehört zu den erfolgreichsten Operationen der Medizin hinsichtlich der Verbesserung der Lebensqualität des Patienten.1 Doch wie können wir mit den heutigen Erfahrungen und technischen Möglichkeiten noch besser werden?
Die anfänglichen Ideen und Entwicklungen u.a. von Wiles2 und Charnley in der Mitte des 20. Jahrhunderts wurden in den letzten Jahrzehnten stets verbessert. Dadurch konnten deutliche Fortschritte hinsichtlich Standzeiten, Patientenzufriedenheit und Reduktion von Komplikationen erreicht werden. Im Laufe der Jahre zeigten sich aber auch Schwächen und Produktversagen einzelner Implantatmaterialien, -paarungen und -designs.
In den 1970er-Jahren waren die Gelenkspaarungen großes Thema, die 1980er wurden durch Diskussionen um die zementierte vs. zementfreie Fixation geprägt, die bis heute anhalten, sodass die Frage weiterhin nicht eindeutig geklärt ist. In den 1990ern wurden neue Gelenkspaarungen eingeführt, darunter Metall-Metall oder Keramik-Keramik. Zudem wurden knochensparende Oberflächenersatzimplantate entwickelt.
Die Erkenntnis in Bezug auf das Versagen von Metall-Metall-Paarungen ergab sich am Beginn des 21. Jahrhunderts. Dies war auch die Zeit, in der alternative Zugangswege in Betracht gezogen wurden und dadurch der Weg zur minimal invasiven Hüftendoprothetik geebnet wurde.
Carl Hüter beschrieb bereits 1881 erstmals einen direkten vorderen Zugang zum Hüftgelenk. In Innsbruck wurde die Idee des intermuskulären, direkt anterioren Zugangsweges von Light und Keggi,3 die als eine der ersten 100 Jahre nach Hüter 1980 diesen Hüftzugang in Zusammenhang mit Hüftendoprothetik beschrieben haben, aufgegriffen und durch Designs der Werkzeuge, Implantate und der OP-Technik zu einer international etablierten Operationsmethode entwickelt.
In den letzten Jahrzehnten hielten Themen wie Navigation und Robotik Einzug im gesamten Spektrum der Medizin und wurden dadurch folglich zu einem „Hot topic“ beim Gelenksersatz.
Das ROBODOC Surgical System4 (Think Surgical; Fremont, California, United States) verwendete einen Roboterarm, um den Schenkelhals aufzufräsen und den femoralen Kanal für den Schaft zu präparieren. Das System wurde 1992 eingeführt und als das erste roboterunterstütze chirurgische Verfahren klinisch angewandt. Auf Basis eines präoperativ durchgeführten CTs der Hüfte wurde ein 3D-Modell des Gelenkes generiert und ein entsprechend der Patientenanatomie orientierter Operationsplan festgelegt. Der Roboterarm arbeitete vollautomatisch und konnte nur mittels Not-Aus gestoppt werden. Dieses System wurde auch an der Universitätsklinik für Orthopädie in Innsbruck verwendet.
CASPAR (Universal Robot Systems; Rastatt, Deutschland) war ein dem ROBODOC ähnliches System zum automatisierten Fräsen des femoralen Kanals und zur Implantatpositionierung. Kadaverstudien attestierten bei Verwendung von CASPAR eine exaktere Schaftpräparation bzw. -implantation.5,6 Dem gegenüber standen jedoch gleiches oder schlechteres klinisches Outcome, höhere Inzidenz eines Trendelenburg-Hinkens und höherer Blutverlust;7 in einer anderen Arbeit (wenn auch nicht statistisch signifikant) längere OP-Zeiten, mehr Komplikationen und eine höhere Rate an heterotopen Ossifikationen.8
ROBODOC wurde weltweit in hunderten von Kliniken verwendet, konnte sich jedoch nicht als Standard in der Hüftendoprothetik etablieren. Infolge einer Sammelklage 2004 in Deutschland musste die Firma Insolvenz anmelden und wurde vom jetzigen Eigentümer Think Surgical übernommen. Basierend auf ROBODOC wurde für die Knieenoprothetik TSolution (Think Surgical; Fremont, Kalifornien, USA) entwickelt und von der FDA zugelassen. Auch die CASPAR-Technik verschwand wieder aus den OP-Sälen.
Weltweit werden derzeit pro Jahr mehr als 1 Million Hüftprothesen implantiert, exemplarisch herausgenommen 370000 in den USA im Jahr 2014, 37000 in Australien und 97000 in England im Jahr 2017. Zwischen 2008 und 2017 stieg in England die jährliche Zahl um 37%, ähnlich auch in Schweden, Neuseeland oder Südkorea. Für 2020 wurden 512000 Hüftersatzoperationen für die USA vorausgesagt.9 Aus diesen Zahlen und der zukünftigen demografischen Entwicklung ergibt sich ein großer Markt und diesen will natürlich auch die Industrie mit Innovationen bedienen.
Wir wollen besser werden. Doch welche Ziele können wir uns setzen, wo besteht Potenzial einer deutlichen Verbesserung?
-
Längere Standzeiten: Eine aktuelle Überblicksarbeit mit Einschluss von knapp 230000 Hüften gibt eine Standzeit von 25 Jahren bei 58% der Patienten an.10
-
Weniger Infekte: Die Inzidenz innerhalb von 2 Jahren nach Implantation liegt bei 1–2%11
-
Weniger Instabilitäten: Ca. 1,4% aller primären Hüfttotalendoprothesen luxieren, im Mittel 40 Tage post OP. Alter, Muskeltonus, Non-Compliance bzgl. luxationsfördernder Bewegungen, operativer Zugangsweg und Prothesensitz/-größe beeinflussen unter anderem die Luxationsrate. Hauptrisikofaktoren sind jedoch: Z.n. spinaler Fusionsoperation, Parkinson-Erkrankung, Demenz und Depression.12
-
Weniger aseptische Lockerungen: 48% aller Revisionsoperationen im englischen Prothesenregister erfolgen aufgrund einer aseptischen Prothesenlockerung, welche in den meisten Fällen durch Abrieb der Gleitflächen zustande kommt.13,14
-
Steigerung der Patientenzufriedenheit
-
Verringerung des Weichteiltraumas
Es gibt viele Einflussfaktoren und Parameter, um eine Verbesserung im Sinne der oben genannten Ziele zu erreichen. Im Prinzip können die Möglichkeiten 3 großen Faktoren zugerechnet werden:
Patient
-
präoperative Patientenkonditionierung
-
antibiotische Therapie
-
Optimierung von Komorbiditäten
-
postoperative Rehabilitation
Chirurg
-
präoperative Planung
-
standardisiertes Vorgehen
-
hohe Fallzahlen
-
akkurate Positionierung der Implantate
-
operativer Zugangsweg
Implantat
-
Materialwissenschaften
-
Implantatdesign
-
Art der Verankerung
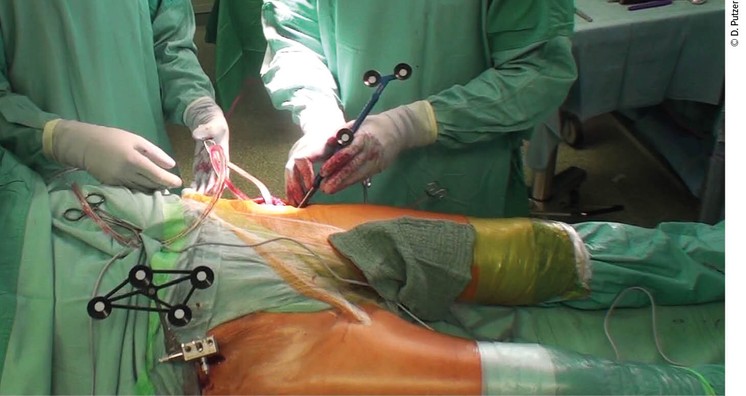
Abb. 1: Infrarot-Marker an der kontralateralen Crista iliaca; Abtasten der femoralen Checkpoints mit dem Tracking-Array-besetzten Pointer
Robotik und Navigation verfolgen das Ziel einer exakten Implantatauswahl und -positionierung hinsichtlich Rekonstruktion der patienteneigenen Anatomie in Offset, Beinlänge, Drehpunkt, „Range of Motion“ und Stabilität. Allerdings unterscheiden sich Robotik und Navigation fundamental. Ein Operationsroboter assistiert beim Fräsen der Pfanne und Einstellen der Anteversion des Schaftes, während ein Navigationsgerät nur die Position eines Implantats, einer Fräse oder einer Raspel im Raum darstellen kann.
Die Hüftprothesenplanung begann historisch gesehen mit dem Auflegen von Schablonen auf das Röntgenbild, welches auf dem Röntgenfilmbetrachter platziert wurde. Die digitale Variante, eine orthopädische Schablonensoftware wie z.B. mediCAD®, stellt für die präoperative Planung aktuell den gebräuchlichsten Standard dar. Auch für die Qualitätssicherung im Rahmen von Zertifizierungsprogrammen ist eine solche Planung obligat.
Eine aktuelle Arbeit konnte nachweisen, dass die präoperative Größenbestimmung der Komponenten mittels Planungssoftware ohne große Abweichungen umgesetzt werden kann.15
Neben der Frästechnik der Pfanne (anfängliches Medialisieren, serielle Größenwahl der Fräsen, stetige Überprüfung der Frästiefe) sowie der Ausrichtung des Pfanneneinschlägers, den man primär nach der Lage im Raum orientiert, gibt es noch die intraoperative Bildwandlerkontrolle, die für die Komponentenplatzierung der Pfanne zur Überprüfung herangezogen werden kann. Auch die Schaftplatzierung bzw. Kopflängenwahl erfolgen primär nach anatomischen Referenzen bzw. nach dem Ergebnis einer Probereposition und der intraoperativen Kontrolle von Stabilität und Beinlänge bzw. einer etwaigen Bildwandlerkontrolle.
Mittlerweile kamen aber neue Themen in der Hüftendoprothetik auf, welche wissenschaftlich aufgearbeitet wurden und den Transfer in den klinischen Alltag finden sollen. Mit der konventionellen Technik der Implantation bestehen jedoch begrenzte Möglichkeiten, dies intraoperativ exakt umzusetzen. Beispiele hierfür sind:
-
präoperative Bewegungsanalysen/ Ganglaborergebnisse
-
kombinierte Anteversion von Schaft und Pfanne
-
funktionelle Beckenkippung und Implantatposition
-
knöchernes und implantatassoziiertes Impingement
Der technische Fortschritt und damit einhergehende Entwicklungen mit Beginn des 21. Jahrhunderts eröffneten Möglichkeiten des Einsatzes computergestützter intraoperativer Assistenzsysteme. Hier gilt es, zwischen Navigation und Robotik zu unterscheiden, wobei in der neuesten Gerätegeneration diese zunehmend miteinander verschmelzen.
Die intraoperative Navigation bot anfänglich die Möglichkeit eines Abgleichs mit präoperativen CT-Datensätzen.16,17 Durch navigationsgestützte Registrierung anatomischer Landmarken, die eine topografische Zuordnung zuließen, konnte auf CT-Bilder verzichtet werden.18,19
Neben der reinen Navigation konnte die orthopädische Robotik als technisches System eine Zulassung und somit medizinische Anwendung finden. Wie bereits erwähnt, war diese mit ROBODOC oder CASPAR als vollautonomes System konzipiert. Doch zentrale Operationsschritte vollständig dem Roboter zu überlassen war komplikationsbehaftet und führte dadurch nicht zu den gewünschten Erfolgen – die Robotik der ersten Generation war Geschichte.
Man konnte aus den Nachteilen der vollautonomen Systeme lernen und entschied sich, einen semiaktiven Operationsroboter zu entwickeln: den MAKO Roboter (Stryker, Kalamazoo, MI, USA). MAKO besteht aus einem Standgerät, an dem ein Roboterarm angebracht ist: das „MAKO Robotic Arm Interactive Orthopaedic System“. Die FDA gab 2008 für Knieendoprothetik und 2010 für Hüftendoprothetik die Zulassung. Nach Firmenangabe sind derzeit mehr als 850 Geräte in 26 Ländern der Welt im Einsatz; mehr als 300000 endoprothetische Eingriffe wurden durchgeführt.20 An der Universitätsklinik für Orthopädie in Innsbruck ist die MAKO-Technologie seit Herbst 2018 erfolgreich im Einsatz.
Die MAKO-Technik
Ablauf einer Hüfttotalendoprothetik mit MAKO im Vergleich zu konventioneller Technik:
1. Präoperative Planung
Basierend auf einer CT-Bildgebung des Beckens und beider Kniegelenke erfolgt eine patientenspezifische Planung von Komponentengröße und -platzierung von Pfanne und Schaft. Dadurch gelingt es, die kombinierte Anteversion von Schaft und Pfanne zu adressieren und ein Impingement der Prothesenkomponenten zu vermeiden. Die Bildgebung liefert Informationen über Beckenkippung, Beinlänge und Offset, sodass eine möglichst anatomische Wiederherstellung verfolgt wird.
2. Setting im OP
Der Patient wird in Rückenlage gelagert, beide Beine werden frei beweglich abgedeckt. Dies entspricht nahezu dem Standardsetting beim direkt anterioren Zugang, lediglich der Beckenkamm an der gegenüberliegenden Seite wird etwas weiter freigelassen, um dort Pins platzieren zu können. Am Tisch stehen der Operateur, ein oder ggf. zwei Assistenten und der Instrumentar. Der Roboterarm wird auf der Seite des Operateurs platziert, etwa auf Höhe des Zugangs. In der Nähe des Patientenkopfes wird die Infrarotkamera platziert. Dem Operateur gegenüber steht der Bildschirm, der in Echtzeit Informationen liefert und vom Medizintechniker bedient wird.
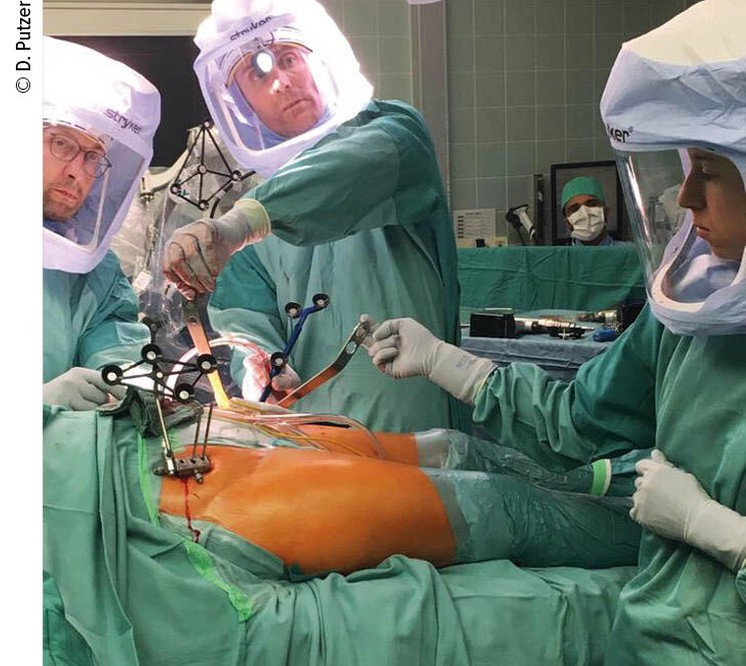
Abb. 2: Abtasten der acetabulären Checkpoints; Infrarotkamera steht mit OP-Monitor dem Operateur gegenüber
3. Operationsablauf
2 Stichinzisionen werden im anterioren Bereich der kontralateralen Crista iliaca gesetzt und 2 Pins werden eingebracht, auf denen der Beckenmarker für die Infrarotkamera befestigt wird. Auf der zu operierenden Seite erfolgt ein klassischer DAA-Zugang. Anterolateral werden am Trochanter major 2 Schrauben gesetzt: eine kleinere „Check-Point“-Schraube und eine größere, auf welcher der Marker für die Infrarotkamera aufgebracht wird. In weiterer Folge wird die femorale Registrierung durchgeführt; hierbei werden mit einem speziellen Pointer 32 Punkte abgetastet (Abb.1).
Nach abgeschlossener Registrierung wird die Osteotomielinie mit einem Kauter entsprechend der Vorgabe am Screen markiert und die Osteotomie mit einer oszillierenden Säge durchgeführt. Entfernen des Hüftkopfes, Exponieren des proximalen Femurs, Beginn mit dem Eröffnen des Femurkanals, Präparation mit sequenziell größer werdenden Raspeln. Die Rotation sollte entsprechend der nativen femoralen (Ante-)Version gewählt werden. Auf die finale Raspel wird ein Probehals aufgesetzt. Dieser bietet 3 Punkte, die mit der Sonde registriert werden. Dadurch werden die femorale Version, der Offset und die Beinlänge errechnet. Vor der Vermessung der Pfanne wird ein zusätzlicher Check-Point außerhalb des Acetabulums am Oberrand gesetzt. Abtasten von 32 Punkten mit der Sonde. Die Position der Pfanne wird entsprechend der Schaftversion, die zuvor registriert wurde, geplant und adaptiert. Die Software gibt eine kombinierte Anteversion geschlechtsadaptiert vor.
Nachdem der Pfannengrund und der Acetabulumrand von sämtlichem Weichteilgewebe gesäubert worden sind (Osteophyten werden belassen), werden neuerlich 32 Punkte im Acetabulumbereich registriert (Abb.2). Anschließend können etwaige Osteophyten entfernt werden. Beginn des Reamens durch den Chirurgen unter Verwendung des Roboterarms, der die Richtung und Tiefe der Pfannenfräse vorgibt (Abb.3) Es wird sofort die in der Größe passende Fräse verwendet. Durch haptisches Feedback (akustischer Piepton, Farbänderung am Screen und Vibrationen am Roboterarm) erfolgt die Rückmeldung an den Chirurgen. Das Reamen wird fortgesetzt, bis die Fläche am Display allseits grün erscheint. Die definitive Pfanne (Trident PSL HA, Stryker, Warsaw, Indiana USA) wird am Roboterarm aufgesetzt und vom Chirurgen eingeschlagen, wobei der Arm wiederum die Ausrichtung und Tiefe exakt gemäß der Planung vorgibt. Die Pfannenposition wird anschließend anhand von 5 abgetasteten Punkten kontrolliert. Einbringen des Inlays. Der endgültige Schaft (Accolade II, Stryker, Warsaw, Indiana, USA) wird manuell eingebracht und ein Probekopf aufgesetzt. Auf die femorale Schraube wird der Marker für die IR-Kamera aufgesetzt – dadurch kann der Chirurg ROM, Stabilität, Beinlänge und Offset kontrollieren. Gemäß der Bewegungsanalyse am Screen wird der definitive Kopf aufgesetzt und sämtliche Marker werden entfernt. Reposition der Hüfte und Wundverschluss.
In Innsbruck wurden bis dato circa 150 Hüfttotalendoprothesen mit dem MAKO-System implantiert.
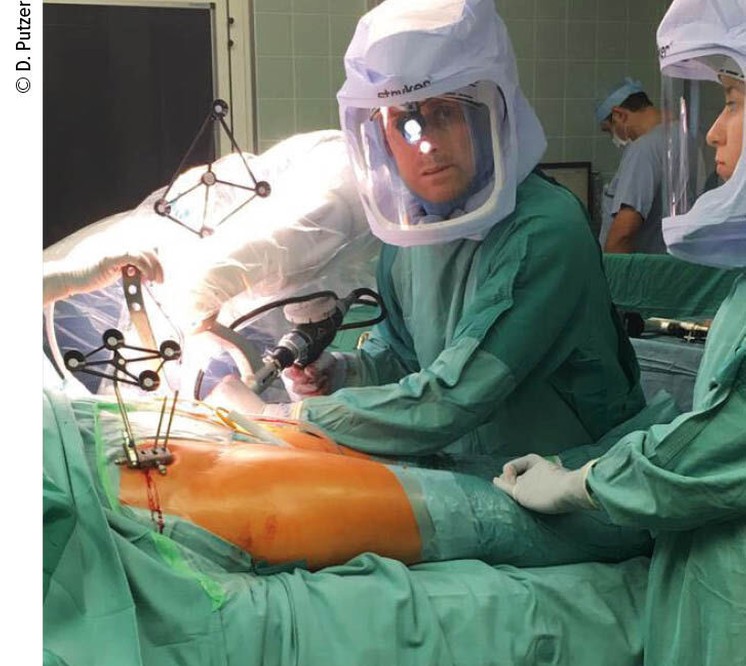
Abb. 3: Reamen der Pfanne nach Vorgabe des Roboterarms, wobei dieser bei etwaiger Bewegung des Beckens stets nachjustiert; Blick des Operateurs auf den Monitor zur visuellen Erfolgskontrolle
Robotik vs. konventionelle Operationstechnik
Gibt es nun eine Überlegenheit der Robotik gegenüber einer konventionell implantierten Hüfttotalendoprothese?
Wenn man sich die Genauigkeit und Präzision der Pfannenposition ansieht, so wurde in mehreren Arbeiten gezeigt, dass mit Robotikbessere Ergebnisse im Vergleich zur konventionellen Implantatplatzierung erreicht werden konnten.21,22In einer retrospektiven Analyse wurden 3 Patientengruppen miteinander hinsichtlich Komponentenplatzierung in der Zielzone verglichen: 100 bildwandlerassistierte THA, 100 roboterassistierte THA und 100 konventionell implantierte THA. In 76% der Fälle wurde der Zielbereich konventionell erreicht, in 84% bildwandlergestützt und in 97% durch den Einsatz von Robotik.23 Doch welchen „Zielbereich“ der Pfannenposition wollen wir erreichen?
Lewinnek beschrieb 1978 eine „safe zone“ (Inklination 40°±10° und Anteversion 15°±10°), in welcher ein geringeres Risiko für postoperative Instabilität besteht. Die Kippung des Beckens, in der Hüftendoprothetik häufig mit der anterioren „pelvic plane“ (durch die beiden Spinae iliacae anteriores superiores und Tubercula pubica referenziert) bezeichnet, ist jedoch keine statische Größe, sondern ändert sich je nach Körperhaltung und Aktivität. Teilweise sind Veränderungen bis zu 20° Beckenkippung möglich.24
Eine weitere Herausforderung ist das Konzept der kombinierten Anteversion. Zementfreie Prothesenschäfte verklemmen sich, oft wenig intraoperativ beeinflussbar, mit einer großen Rotationsbandbreite zwischen –19° Retrotorsion und 45° Antetorsion.25 Daraus kann sich ein eingeschränktes Bewegungsausmaß mit Impingementproblematik ergeben, wobei die Antetorsion des Schaftes einen entscheidenden Parameter darstellt.26 Daraus wurde die Idee des „Femur first“-Prinzips entwickelt, d.h., der Schaft wird implantiert und erst danach die Pfanne entsprechend der Schaftrotation adaptiert eingesetzt. Da sowohl das Einbeziehen der dynamischen Beckenkippung als auch die schaftrotationsreferenzierte Pfannenimplantation mit konventioneller OP-Technik nicht exakt umgesetzt werden, kommt die Robotik in den Fokus der endoprothetischen Chirurgie.
Nachteile der Robotik sind sowohl ein prä- und intraoperativ erhöhter Zeitaufwand (in einer Metaanalyse werden durchschnittlich 21 Minuten genannt)27 als auch ein finanzieller Mehraufwand. In der Robotik werden Anschaffungskosten zwischen 600000USD und 1500000USD angegeben.22 Zusätzlich einschränkend kann sein, dass Systeme nur mit Implantaten des gleichen Herstellers arbeiten können. Unsere Daten zeigen einen zeitlichen Mehraufwand von circa 10 Minuten pro Operation.
Die Robotik ist auch ein Instrument, um die Qualität der Operationsschritte, Implantatpositionierung und -ausrichtung zu überprüfen. Verglichen mit der Navigation oder der Robotik in der Anfangszeit (ROBODOC, ...), bedeutet der Operationsroboter MAKO eine deutliche Verbesserung in der Patientenversorgung im Operationssaal. Allerdings wird die Evidenz der nächsten Jahre zeigen, ob dieser Vorteil bei der Operation auch positive langfristige Auswirkungen auf die Patientenzufriedenheit hat.
Abschließend bleibt somit die Frage, ob Robotik in der Endoprothetik in Zukunft ein „nice to have“ ist, ein „must have“ ist oder sich sogar als Standard etabliert.