DFP-Literatur: Differenzialdiagnostik der Dyspnoe
Patient mit Atemnot
Atemnot aus Sicht der Patienten betrachtet ist immer das subjektive Gefühl, zu wenig Luft zu bekommen. Die Ursachen einer Dyspnoe sind ebenso vielfältig wie die Beschreibungen der Beschwerden durch die Patienten. Daher sind eine sorgfältige Anamnese und Diagnostik essenziell, um die geeignete Therapie einleiten zu können.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf allgemeineplus.at und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. universimed.com & med-Diplom.at)
Nicht immer weisen die Aussagen der Patienten zu ihren Beschwerden in Richtung einer korrekten Diagnosestellung. Im Fall von Atemnot, vor allem bei Asthma, können auch Berichte von einem Engegefühl in der Brust vorkommen, die dann häufig zu einer kardiologischen Abklärung führen.1 In der Regel bleiben die kardiologischen Untersuchungen dann ohne Befund. Genau hinhören sollte man auch bei Patienten, die angeben, dass sie kaum noch körperlich aktiv sind und „am liebsten vor dem Fernseher sitzen“. Dies kann ein Hinweis darauf sein, dass sie sich deshalb nicht mehr belasten, weil sie dann unter Atemnot leiden. Hier empfiehlt es sich nachzufragen, ob das schon immer so war oder ob sie früher aktiver waren.
Ursachen der Dyspnoe
Man unterscheidet die akute Dyspnoe, die innerhalb von Minuten bis zu wenigen Stunden auftritt, von der chronischen Dyspnoe. Die häufigsten Ursachen der akuten Dyspnoe sind in Tabelle 1 genannt. Die chronische Dyspnoe entwickelt sich im Verlauf von Wochen bis Monaten. Häufige pneumologische Ursachen sind Asthma, COPD oder eine interstitielle Lungenerkrankung. Als kardiologische Ursache steht die Herzinsuffizienz an vorderster Stelle. Wichtig ist, dass bei der chronischen Atemnot in etwa einem Drittel der Fälle der erste Eindruck der Ursache falsch ist!2 Deshalb ist eine strukturierte Untersuchung essenziell (Tab. 2). Zur Basisdiagnostik gehören die Auskultation und Perkussion sowie das Bestimmen der Atemfrequenz. Letztere ist ein sehr sensitiver Marker für Atembeschwerden: Atmet der Patient ruhig und gleichmäßig oder hat er bereits beim Sprechen Mühe? Wertvolle Hinweise liefert auch die Atemhilfsmuskulatur, die sich beispielsweise bei schwerer COPD infolge der erhöhten Atemlast als interkostale Einziehung darstellt.
Kasuistiken
Fall 1:
Raucher mit neu aufgetretener Dyspnoe

Der Patient stellt sich mit einer seit drei Tagen bestehenden Dyspnoe vor, die sich zunehmend verschlimmert und zuletzt auch in Ruhe auftritt. Er hat weder Fieber noch Auswurf. Seine Atemfrequenz ist erhöht und liegt bei 22/Minute. Auch der Puls ist beschleunigt und beträgt 109/Minute. Sein Blutdruck liegt bei 155/75mmHg; er weist diskrete Ödeme an beiden Beinen auf. Auskultatorisch sind beim Ausatmen Giemen und Pfeifen zu hören. Die Sauerstoffsättigung wurde ebenfalls bestimmt und beträgt bei Raumluft 89%.
Die eingeleiteten Laboruntersuchungen ergeben ein Blutbild ohne besonderen Befund, einen Kreatininwert von 1,2mg/dl mit einer kalkulierten glomerulären Filtrationsrate (eGFR) von 65ml/min und einen normalen Wert von C-reaktivem Protein (CRP). Troponin T und die Kreatininkinase sind negativ, während das B-natriuretische Peptid (BNP) mit 650pg/ml deutlich erhöht ist.
Im EKG finden sich lediglich unspezifische Repolarisationsstörungen. Die Röntgenaufnahme des Thorax zeigt ein vergrößertes Herz und eine Blutumverteilung. Aufgrund dieser Befunde wird eine akute kardiale Dekompensation infolge einer Herzinsuffizienz diagnostiziert.
Diagnose: akute kardiale Dekompensation
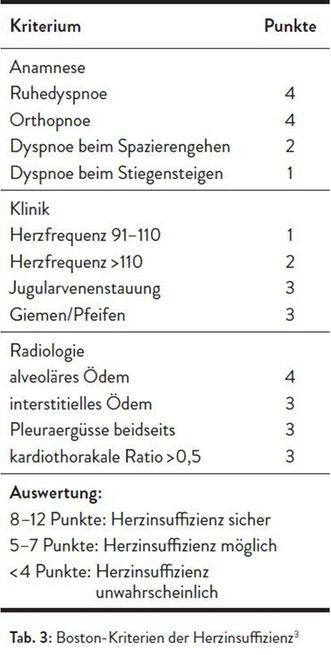
Sie ist eine häufige Ursache für Spitalsaufenthalte und mit einer erhöhten Mortalität verbunden. Diese liegt im Spital bei rund 4%, bei beatmeten Patienten bei bis zu 35%. Klinisch zeichnet sie sich durch das akute Auftreten einer Dyspnoe, Tachypnoe oder Orthopnoe aus. Zudem werden Tachykardie und Hypertonie beobachtet. Typisch sind auch periphere Ödeme und deutlich gefüllte Halsvenen. Bei der Auskultation sind feuchte Rasselgeräusche und manchmal Giemen (Asthma cardiale) zu hören. Tabelle 3 fasst die diagnostischen Kriterien einer Herzinsuffizienz zusammen.3
Differenzialdiagnostisch sind COPD und Asthma auszuschließen. Dazu ist das Thoraxröntgen hilfreich. Bei Asthma oder COPD können im Thoraxröntgen im Falle einer Überblähung ein Zwerchfelltiefstand bzw. ein abgeflachtes Zwerchfell, verbreiterte Interkostalräume und ein vergrößerter Retrosternalraum festgestellt werden. Dagegen zeigen sich bei der akuten kardialen Dekompensation je nach Schweregrad bilateral perihiläre alveoläre Verschattungen, eine Blutumverteilung, ein verbreiteter Herzschatten und beidseitige Winkelergüsse.
Ein anderer hilfreicher Parameter ist das BNP. Ein negatives BNP schließt eine Herzinsuffizienz als Ursache der Atemnot weitgehend aus. Werte über 100pg/ml sprechen dagegen mit einer Vorhersagegenauigkeit von 83% oder mehr für eine Herzinsuffizienz als Dyspnoeursache. Allerdings sind eine Reihe von Krankheiten mit erhöhten BNP-Werten verbunden, zum Beispiel Vorhofflimmern, Cor pulmonale und chronische Niereninsuffizienz. Oft wird auch vergessen, dass es bei adipösen Menschen zu falsch-niedrigen BNP-Werten kommt.4
Asthma cardiale
Immerhin rund ein Drittel der Patienten mit akuter Dekompensation ihrer Herzinsuffizienz leiden auch an obstruktiven Atembeschwerden. Risikofaktoren dafür sind vor allem Rauchen, COPD und eine periphere arterielle Verschlusskrankheit (PAVK).5
Durch die Herzinsuffizienz erhöht sich auch der Füllungsdruck im Kapillarbett der Lunge, was zu einer vermehrten Flüssigkeitsansammlung im Interstitium führt. Daraus resultiert eine stärkere Atemlast, da pulmonale Stretchrezeptoren die Flüssigkeitsvermehrung an den Hirnstamm melden und daraufhin kompensatorisch die Atemfrequenz gesteigert wird. Dies soll den Abtransport der Flüssigkeit im Interstitium bewirken.6
Therapie und stationäre Aufnahme
Patienten mit hämodynamischer Beeinträchtigung müssen stationär behandelt werden. Das Gleiche gilt beispielsweise bei Bewusstseinstrübung, Sauerstoffsättigung <90%, neu aufgetretenem Vorhofflimmern, akutem Koronarsyndrom oder auch sozialen Gründen.7 Eine Übersicht über die Therapie gibt Tabelle 4.
Kasuistiken
Fall 2:
Arzt mit trockenem Husten, Dyspnoe seit 10 Tagen und thorakalen Schmerzen

Der Patient berichtet von trockenem Husten und Dyspnoe, die seit zehn Tagen bestehen und zuletzt auch bei geringer Anstrengung auftreten. Hämoptysen hat er nicht. Außerdem leidet er an diskreten thorakalen Schmerzen linksseitig. Die Basisuntersuchung ergibt einen erhöhten Blutdruck (170/100mmHg), eine erhöhte Atemfrequenz (20/min) und leicht beschleunigten Puls (90/min). Auskultation, EKG und Thoraxröntgen sind unauffällig; das Blutbild ist normal und das CRP ist nicht erhöht. Wadenschmerzen hat der Patient nicht.
Diagnose: beidseitige zentrale Lungenembolie
Die Lungenembolie ist nach dem Herzinfarkt und dem Schlaganfall die dritthäufigste Todesursache und in der Europäischen Union (EU) für mehr als 500 000 Todesfälle pro Jahr mitverantwortlich.8, 9 In den USA kommt es jährlich zu mehr als 500 000 Hospitalisierungen aufgrund einer Lungenembolie.10 Differenzialdiagnostisch müssen unter anderem Herzinfarkt, Pleuritis, Bronchopneumonie, Pneumothorax und Aortendissektion ausgeschlossen werden.11 Für die Abklärung ist die sogenannte klinische Vortest-Wahrscheinlichkeit wichtig, gefolgt von einer Basisdiagnostik und darauf aufbauend der Risikostratifizierung, ob der Patient ambulant oder stationär weiterbehandelt werden muss.
Die klinische Vortest-Wahrscheinlichkeit (Wells-Score)
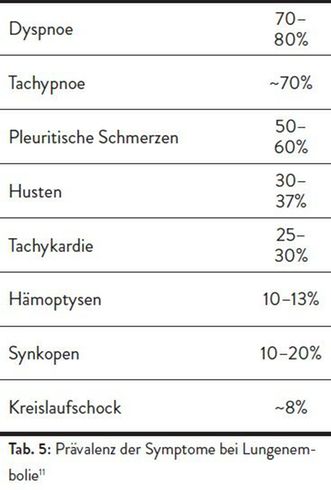
Die klassischen Symptome einer Lungenembolie und ihre Prävalenz sind in Tabelle 5 aufgeführt. Der Wells-Score erlaubt es, anhand einfach zu bestimmender Kriterien die Vortest- Wahrscheinlichkeit für das Vorliegen einer Lungenembolie zu ermitteln. Dazu gehören:
klinische Symptome einer tiefen Beinvenenthrombose
Andere Diagnosen sind unwahrscheinlich. (Gibt es eine andere Ursache, die die Symptome erklären kann?)
Herzfrequenz >100/min
Immobilisation >3 Tage oder Operation vor weniger als 4 Wochen
frühere Lungenembolie oder tiefe Beinvenenthrombose
Hämoptysen
Neoplasien
In der vereinfachten Version des Scores wird für jede positive Antwort ein Punkt vergeben. Bei zwei oder mehr Punkten ist eine Lungenembolie möglich und wahrscheinlich. Der Wells-Score ist in dem o.a. klinischen Fall entscheidend, da auf Basis der vorliegenden Erstbefunde keine klare Diagnose für die beschriebene Symptomatik festgestellt werden konnte. Folglich ist eine erweiterte Diagnostik (Stufe-2-Diagnostik), in diesem Fall eine Thorax-CT, zur weiteren Differenzialdiagnose von Bedeutung.
D-Dimer-Bestimmung
Das D-Dimer sollte erst nach der Erhebung der Vortest-Wahrscheinlichkeit bestimmt werden und nicht umgekehrt.11 Der D-Dimer- Test hat einen hohen negativen Vorhersagewert: Ergibt sich eine geringe klinische Wahrscheinlichkeit für eine Lungenembolie, bestätigt ein negativer D-Dimer-Test dies. Bei einer hohen klinischen Wahrscheinlichkeit für eine Lungenembolie und negativem D-Dimer-Test besteht immerhin eine Wahrscheinlichkeit von bis zu 28% für das Vorliegen einer Lungenembolie.
Der positive Vorhersagewert eines erhöhten D-Dimers ist gering, weil es auch durch eine Reihe anderer Ursachen erhöht sein kann, zum Beispiel bei Entzündungen, Traumata, Tumoren oder nach Operationen. Der D-Dimer-Test ist daher nicht zur Bestätigung, sondern nur zum Ausschluss einer Lungenembolie geeignet.11
Auffällige Anzeichen im EKG bei Lungenembolie
Die häufigsten Veränderungen sind eher unspezifisch: Tachykardie mit einer Frequenz von >100/min (38%), ST-Hebung (36%), T-Inversion (29%). Der als typisch beschriebene S1Q3-Typ tritt dagegen nur bei 24% der Patienten auf. Finden sich bei Patienten mit einer Lungenembolie EKG-Veränderungen, steigen das Risiko für einen kardiozirkulatorischen Schock und die Mortalität.
Weiteres Vorgehen
Für die Frage, ob ein Patient stationär aufgenommen werden muss, sind vor allem die voraussichtlichen hämodynamischen Konsequenzen wichtig. Außerdem spielen Komorbiditäten und – meist damit verbunden – das Alter eine Rolle.11 Hat ein Patient keine weiteren Risikofaktoren, könnte er theoretisch auch ambulant behandelt werden, was jedoch hierzulande in der Regel nicht geschieht.
Kasuistiken
Fall 3:
ältere COPD-Patientin mit zunehmender Dyspnoe seit 3 Tagen

Die Patientin stellt sich mit den Symptomen Dyspnoe, Husten und gelblichem Auswurf vor, die seit drei Tagen bestehen. Sie hat zudem eine subfebrile Temperatur und leidet an Inappetenz.
Die klinische Untersuchung zeigt eine vermehrte Atemanstrengung, Giemen, eine Tachykardie (125/min) und Bluthochdruck (150/95mmHg). Die Sauerstoffsättigung mit 2l Sauerstoff liegt bei 88%.
Diagnose: akute Exazerbation der COPD
Typische Anzeichen sind in jedem Fall Husten, vermehrter oder veränderter Auswurf (z.B. eitrig), (akute) Zunahme der Dyspnoe. Bedrohlich ist es, wenn nichts zu hören ist („stille Lunge“), denn dann sind Emphysem und Bronchospasmus so stark ausgeprägt, dass kein Atemgeräusch zu vernehmen ist.
Die Patientin sollte stationär aufgenommen werden, denn es handelt sich vor allem aufgrund der Komorbiditäten und der Inappetenz um eine Hochrisikopatientin.
Die wichtigsten Differenzialdiagnosen sind:
Exazerbation eines Asthma bronchiale
kardiale Dekompensation
Fremdkörperaspiration (selten)
Stimmbanddysfunktion (selten)
Therapie der akuten COPD-Exazerbation
Patienten, die ambulant behandelt werden können, erhalten Prednisolon (25–50mg p.o. für 5 Tage). Patienten, die bereits unter Kortison stehen, dürfen mit einer höheren Dosis und länger behandelt werden. Wichtig ist eine rasch wirksame, inhalative Bronchodilatation, in erster Linie mit Beta-2-Sympathomimetika und/oder Anticholinergika, vorzugsweise mit einem Spacer. Bei vielen, jedoch nicht bei allen Patienten ist eine Antibiotikatherapie angezeigt. Sinnvoll ist sie vor allem bei Patienten mit einer schweren COPD, vor allem wenn eine putride Bronchitis oder andere klinische Infektzeichen vorliegen. Zudem ist eine Sauerstoffgabe bis zu einer Sättigung von 88–92% indiziert. Eine höhere Sättigung sollte nicht angestrebt werden, um eine sauerstoffinduzierte Hyperkapnie zu vermeiden.17
Eine Beatmung ist notwendig, wenn ein Patient trotz optimierter medikamentöser Therapie Anzeichen einer akuten respiratorischen Globalinsuffizienz zeigt. Diese ist charakterisiert durch einen pH-Wert <7,35, paCO2 >50mmHg und eine Atemfrequenz >25/min sowie Anzeichen von Erschöpfung und vegetativem Disstress.18
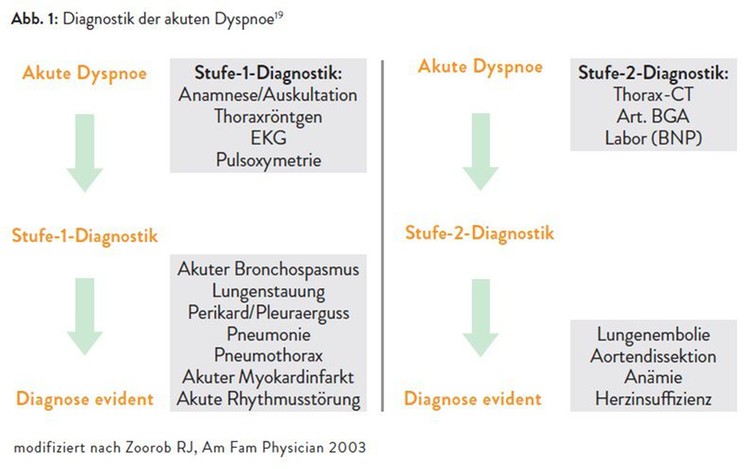
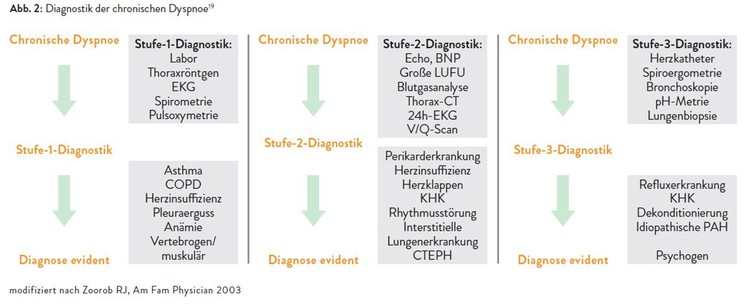
Die Abbildungen 1 und 2 fassen noch einmal die stufenweise Diagnostik zur Abklärung der akuten und der chronischen Dyspnoe zusammen (adaptiert nach Zoorob et al. 2003).19
Literatur
Schwartzstein RM: The language of dyspnoea. Eur Respir Rev 2002; 12: 82: 28-30
Pratter MR et al.: Cause and evaluation of chronic dyspnea in a pulmonary disease clinic. Arch Intern Med 1989; 149: 2277-82
Marantz PR et al.: The relationship between left ventricular systolic function and congestive heart failure diagnosed by clinical criteria. Circulation 1988; 77: 607-12
Maisel AS et al.: Rapid measurement of B-type natriuretic peptide in the emergency diagnosis of heart failure. N Engl J Med 2002; 347: 161-7
Jorge S et al.: Cardiac asthma in elderly patients: incidence, clinical presentation and outcome. BMC Cardiovasc Disord 2007; 7: 16
Ware LB, Matthay MA: Clinical practice. Acute pulmonary edema. N Engl J Med 2005; 353: 2788-96
Heart Failure Society of America: HFSA 2010 Comprehensive Heart Failure Practice Guideline. J Card Fail 2010; 16: e1-194
Cohen AT et al.: Venous thromboembolism (VTE) in Europe. The number of VTE events and associated morbidity and mortality. Thromb Haemost 2007; 98: 756-64
Goldhaber SZ: Venous thromboembolism: epidemiology and magnitude of the problem. Best Pract Res Clin Haematol 2012; 25: 235-42
Centers for Disease Control and Prevention (CDC): Venous thromboembolism in adult hospitalizations – United States, 2007-2009. MMWR Morb Mortal
Wkly Rep 2012; 61: 401-4Konstantinides SV et al.: 2014 ESC guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J 2014; 35: 3033-69
Stein PD et al.: Clinical, laboratory, roentgenographic, and electrocardiographic findings in patients with acute pulmonary embolism and no pre-existing
cardiac or pulmonary disease. Chest 1991; 100: 598-603Wells PS et al.: Derivation of a simple clinical model to categorize patients probability of pulmonary embolism: increasing the models utility with the SimpliRED D-dimer. Thromb Haemost 2000; 83: 416-20
Shopp JD et al.: Findings from 12-lead electrocardiography that predict circulatory shock from pulmonary embolism: systematic review and meta-analysis. Acad Emerg Med 2015; 22: 1127-37
Mohan A et al.: Clinical presentation and predictors of outcome in patients with severe acute exacerbation of chronic obstructive pulmonary disease requiring admission to intensive care unit. BMC Pulm Med 2006; 6: 27
Vestbo J: Clinical assessment, staging, and epidemiology of chronic obstructive pulmonary disease exacerbations. Proc Am Thorac Soc 2006; 3: 252-6
2019 Global Strategy for Prevention, Diagnosis and Management of COPD (https://goldcopd.org/gold-reports; Zugriff 08.03.2019)
Vogelmeier C et al.: S2k-Leitlinie zur Diagnostik und Therapie von Patienten mit chronisch obstruktiver Bronchitis und Lungenemphysem (COPD). Pneumologie 2018; 72: 253-308
Zoorob RJ, Campbell JS: Acute dyspnea in the office. Am Fam Physician 2003; 68: 1803-10