5. Mai 2021
Metastasiertes HR+/HER2– Mammakarzinom
Neue Therapiestrategien abseits der Chemotherapie
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf allgemeineplus.at und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. universimed.com & med-Diplom.at)
Der sich stetig vergrössernde Wissensschatz auf dem Gebiet molekularpathologischer Prozesse erlaubt es, eine Reihe neuer Therapiewege abseits der klassischen Chemotherapie zu beschreiten. Patientinnen mit metastasiertem HR (Hormonrezeptor)-positivem/ HER2 («human epidermal growth factor receptor 2»)-negativem Mammakarzinom können dabei gegebenenfalls von einer Inhibierung Wachstumsfaktor-spezifischer Signalwege, wie des PI3K(Phosphoinositid-3-Kinase)-Signalwegs, profitieren.
Die letzten 10 Jahre der Onkologie waren durch eine zunehmende Subspezialisierungstendenz gekennzeichnet. Interdisziplinäre Besprechungen an Tumorboards wurden definitiv etabliert, neu haben sich organzentrierte interdisziplinäre Fallbesprechungen etabliert. Diese Subspezialisierung wird durch das explodierende Fachwissen getrieben. Immer grösseres Wissen um molekularbiologische und molekulargenetische Prozesse eröffnen bei verschiedensten Tumorentitäten neue Therapiewege, die ausserhalb der klassischen Chemotherapie liegen.
Die Aufsplittung von grossen Tumortypen in kleine Subgruppen führt zu einer «Orphanisierung» von Krebserkrankungen. Als klassisches Beispiel gilt das nicht kleinzellige Bronchuskarzinom. Noch vor etwas mehr als 10 Jahren erfolgte die histologische Typisierung in Plattenepithelkarzinome, grosszellige Karzinome und Adenokarzinome. 10 Jahre später wird bei >50% der bronchialen Adenokarzinome eine wichtige genetische Veränderung entdeckt, welche sich prognostisch oder prädiktiv-therapeutisch auswirkt. Die Suche nach genetischen Veränderungen wie EGFR(«Epidermal growth factor receptor»)-Mutation, EML4-ALK(«Echinoderm microtubule-associated protein-like 4»-Alkalische Phosphatase)-Fusion, ROS1-Mutation beziehungsweise Amplifikation auf dem MET-, RET-Gen und sehr selten BRAF-Mutationen (V600E) wie auch NTRK(Neutrophe Tyrosinkinase)-Fusionen eröffnen nicht- chemotherapeutische Behandlungsoptionen. Diese mutationsspezifischen Inhibitoren (Tyrosinkinase-Inhibitoren, TKI) sind in randomisierten Studien einer konventionellen Chemotherapie überlegen.
Langwieriger Weg
Im Gegensatz zu anderen Krebserkrankungen ist das HR+ Mammakarzinom ein recht mutationsarmer Tumor und entsprechend ist der Weg weg von der Chemotherapie länger. Nur das BRCA(«Breast cancer»)-1/2-assoziierte Mammakarzinom stellt neu einen klaren Subtyp eines Mammakarzinoms dar, welcher in der Erstlinienbehandlung nicht primär mit Chemotherapie, sondern mit einem PARP(Poly[ADP-ribose]-Polymerase 1)-Inhibitor wie Olaparib oder Talazoparib behandelt wird. Für das metastasierte, HR+/HER2-negative Mammakarzinom eröffnen die neuen Hormonmodulationsbehandlungen die Möglichkeit, die Notwendigkeit für eine palliative Chemotherapie um Monate bis wenige Jahre hinauszuzögern.
Die Einführung der Aromastasehemmer (AI) zur Behandlung des HR+ Mammakarzinoms um die Jahrtausendwende hat im Gegensatz zur endokrinen Therapie mit Tamoxifen eine Verlängerung des progressionsfreien Überlebens (PFS) von nur wenigen Monaten erbracht (Anastrazol +5,5 Monate, Letrozol +3,4 Monate, Exemestan +4,1 Monate). Auch die Einführung von Fulvestrant als weiterer endokriner Therapieoption hat die Prognose der HR+ Mammakarzinome nur unwesentlich verbessert. Erst die höher dosierte Verabreichung von Fulvestrant (500mg/Monat) zeigte in der FALCON-Studie eine gewisse Progressionsverzögerung zur AI-Therapie, vor allem bei Mammakarzinompatientinnen ohne viszerale Metastasen.
PI3K-Signalweg als Angriffspunkt
Heute liegen die progressionsfreien Überlebenszeiten unter neuen endokrinen Kombinationsbehandlungen mit CDK(«Cyclin-dependent kinase»)4/6-Inhibitoren und PI3K(Phosphoinositid-3-Kinase)-Inhibitoren über 20 Monate. Die Erkenntnis zu Hormonresistenzentwicklungen, bei welchen der klassische Wirkungsweg der endokrinen Therapie («genomic pathway») durch einen «non-genomic pathway» überfahren wird, eröffnete neue Therapieoptionen in der Modulation der endokrinen Therapie. Die Blockierung von Signalwegen der Wachstumsfaktorrezeptoren wie des PI3K-Signalweges führte zu einer Optimierung der endokrinen Behandlung des HR+/HER2– Mammakarzinoms. Die Möglichkeit der Blockierung des PI3K-Signalweges besteht in der Inhibition des mTORC1 («mechanistic target of rapamycin complex 1»), in der Inhibition des PI3K-Proteins oder in der Zellzyklusinhibition mittels CDK4/6-Inhibitor.
Die erste Studie, welche die Überlegenheit der endokrinen Modulation zeigte, war die placebokontrollierte Phase-III-Studie BOLERO-2, welche Everolimus mit Exemestan gegenüber Exemestan alleine verglich. Das PFS war um knapp 6Monate länger (10,6 Monate versus 4,1 Monate). Der Profit dieser Kombination von Everolimus und Exemestan ist unabhängig vom Nachweis einer Pathway-aktivierenden PIK3CA-Mutation, welche bei ca. 40% aller HR+/HER2– Mammakarzinome nachgewiesen werden kann.
Palbociclib, Ribociclib, Abemaciclib
Auch bei der Therapieoption mit CDK-4/6-Inhibitoren liegen noch keine klaren prädiktiven Marker vor, welche diese Therapieansprechen besser einschätzen lassen. Erste Studien über Biomarkeranalysen an zirkulärer t-DNA weisen auf gewisse prädiktiv-therapeutische günstige Veränderungen hin («Mouse double minute 2 homolog» [MDM2], ERBB2, AKT1 und BRCA-1/2). CDK4/6-Inhibitoren wirken als Inhibitoren auf die Zyklin-D-abhängigen Kinasen 4 und 6 und verhindern somit die Aktivierung des Retinoblastom-Proteins (Rb), welche den Start und Eintritt der Zelle in den Zellteilungszyklus regelt. Die verschiedenen CDK4/6-Inhibitoren (Palbociclib, Ribociclib, Abemaciclib) unterschieden sich in der Potenz der CDK4- und CDK6-Inhibition. Entsprechend haben sie bei stärkerer CDK6-Inhibition mehr hämatologische Toxizitäten (Palbociclib, Ribociclib) oder bei stärkerer Inhibierung von CDK4 mehr gastrointestinale Nebenwirkungen (Diarrhö). Alle diese drei Wirkstoffe haben in Phase-III-Studien ihre Überlegenheit gezeigt. In der Erstlinientherapie in Kombination mit einem AI führen sie nicht nur zur Verlängerung des PFS, sondern auch zur Überlebensverlängerung. In der Therapiekombination Fulvestrant/Palbociclib zeigte die PALOMA-3-Studie einen Gewinn bezüglich des medianen Überlebens von 6,9 Monaten. In der entsprechenden Studie für Abemaciclib (MONARCH-2) liegt der Überlebensvorteil bei 9,4 Monaten (37,3 versus 46,7 Monate). Den grössten Profit, der auch früh einsetzt, erreichen Patienten mit aggressiveren HR+/HER2– Mammakarzinomen (höheres Tumorgrading, negativer Progesteronre- zeptor(PR)-Status, viszerale Beteiligung). Die beiden Ribociclib-Studien mit Letrozol (MONALEESA-2) und Fulvestrant (MONALEESA-3) wie auch die Studie, welche prämenopausale Patienten mit kombinierter Therapie (AI/Tamoxifen plus «Gonadotropin releasing hormone» [GnRH]) einschloss (MONALEESA-7), schneiden signifikant besser ab als die alleinige endokrine Therapie. Die MONALEESA-3-Studie zeigt eine Todesfallreduktionsrate um 28% und die MONALEESA-7-Studie eine um 29%. Mit diesen besseren Survival-Daten gilt die CDK4/6-Inhibition als Standard für die Erstlinien-Hormontherapie nach Diagnose einer metastasierenden HR+/HER2– Mammakarzinomerkrankung.
Auch beim älteren Menschen im Alter >75 Jahre schneidet die Therapiekombination eines CDK4/6-Inhibitors in Kombination mit einem AI wesentlich besser ab. Vorsicht ist geboten angesichts der höheren Toxizitätsraten bei älteren Menschen >75 Jahre unter Standarddosierungen. Auch Patienten mit viszeraler Metastasierung und Patienten mit primärer oder sekundärer Hormonresistenz profitieren von einem CDK4-Inhibitor. Der Nachweis von viszeralen Metastasen stellt in der heutigen Behandlungsoptionslage keine klare Indikation mehr zur Chemotherapie dar. Nur bei «viszeralen Krisen» sind Kombinationschemotherapien indiziert. Die PEARL-Studie, welche Fulvestrant und Palbociclib mit der Capecitabin-Mono-Chemotherapie vergleicht, zeigt ein vergleichbares PFS bei vergleichbaren Ansprechraten (Fulvestrant + Palbociclib: 27%, Capecitabin: 33%). Neu ist die Behandlungsoption der PI3K-Inhibiton. Die untersuchten Inhibitoren Taselisib und Buparlisib sind wegen zu geringer Wirkung oder zu hoher Nebenwirkungsrate gescheitert.
SOLAR-1 und BYLieve zu Alpelisib
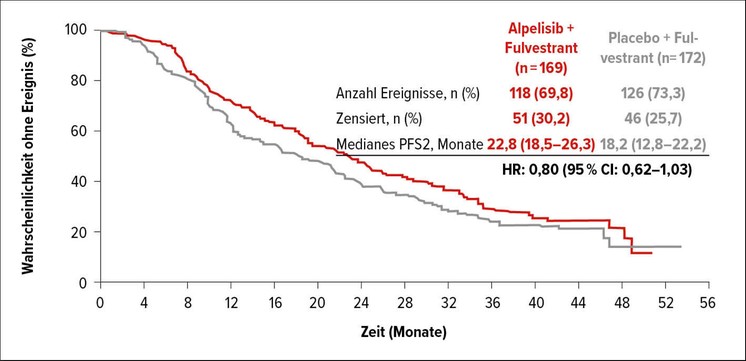
Der alphaspezifische PI3K-Inhibitor Alpelisib bewirkt im Vergleich zur alleinigen endokrinen Behandlung eine relevante Verbesserung der Therapieoptionen für das HR+/HER2– Mammakarzinom mit nachweisbarer PIK3CA-Mutation. In der SOLAR-1-Studie wurde Alpelisib 300 mg/Tag in Kombination mit Fulvestrant für Patienten mit PIK3CA-Mutation oder -Wildtyp untersucht. Die Tumorgrössenreduktion unter der Kombination Alpelisib/Fulvestrant liegt bei Patienten mit nachgewiesener PIK3CA-Mutation bei knapp 76%. Dies führt zu einer statistisch signifikanten Verlängerung des PFS von4,6 Monaten (Abb. 1). Dieser Profit kann im PIK3CA-Wildtyp Patientenkollektiv nicht nachgewiesen werden. Die positive Wirkung von Alpelisib bei PIK3CA-Mutation kann bei Patienten mit primärer oder sekundärer Hormonresistenz gesehen werden. Obwohl das mediane Überleben in der Alpelisib-Gruppe um 7,9 Monate länger ist, wird das Gesamtüberleben durch das Medikament nur im Trend und nicht signifikant verbessert. Alpelisib ist bezüglich Nebenwirkungen nicht ganz unproblematisch. Im Vordergrund stehen die Entwicklung eines Diabetes mellitus bei 65% der Patienten und relativ ausgeprägte gastrointestinale Nebenwirkungen sowie kutane Reaktionen. Die Blutzuckerentgleisung kann häufig durch orale Antidiabetika kontrolliert werden. Da in der SOLAR-1-Studie kaum Patienten mit einem CDK4/6-Inhibitor vorbehandelt worden waren, entspricht der Einsatz von Alpelisib am jetzigen Patientenkollektiv nicht der Real-World-Situation. Heutzutage ist eine Mehrheit der Patienten mit einem CDK4/6-Inhibitor vorbehandelt. Die BYLieve-Studie erlaubte die Vorbehandlung mit einem CDK4/6-Inhibitor und untersuchte die Wirkung der Kombination Alpelisib/Fulvestrant. Das Ausmass der Tumorgrössenreduktion zwischen der SOLAR-1-Studie und der BYLieve-Studie zeigt nur minimale Unterschiede (SOLAR-1: 75,9%, BYLieve: 70,1%). Daher ist anzunehmen, dass auch Patienten mit einer CDK4/6-Vorbehandlung von Alpelisib profitieren können. Aus diesem Grunde wird im Therapiealgorithmus als Erstlinientherapie der Einsatz eines CDK4/6-Inhibitors auch bei Patienten mit nachgewiesener PIK3CA-Mutation bevorzugt und Alpelisib als Zeitlinienoption angewendet. Falls der CDK4/6-Inhibitor in der Erstlinienbehandlung nicht verabreicht worden ist, stellt er in der zweiten Linie die erste Therapieoption dar.
Abb. 1: Abschliessende Daten zum PFS in der SOLAR-1 Studie mit Alpelisib/Fulvestrant. Modifiziert nach André F et al. 2020
Fazit
Insgesamt haben die neuen Optionen der Inhibition des PI3K-Signalweges zu einer Optimierung der endokrinen Behandlungsoption geführt und bewirken, dass der Einsatz einer palliativen Chemotherapie um mehrere Monate verzögert werden kann. Der Weg weg von der Chemotherapie ist lang und steinig und aufgrund von Nebenwirkungen der neuen Medikamente nicht ganz unproblematisch und untoxisch. Aus diesem Grunde müssen diese Behandlungen in Bezug auf Lebensqualität bei höherem Alter situationsabhängig gegenüber einer wenig belastenden Mono-Chemotherapie gut abgewogen werden.