DFP-Literatur: Neue Leitlinie zu Gefäß- und Lipidmanagement
Je niedriger, desto besser
Ende August wurde von der European Society of Cardiology (ESC) und der European Atherosclerosis Society (EAS) die überarbeitete Leitlinie zum Management von Dyslipidämien veröffentlicht.1 Sie hat einige der früheren Erkenntnisse bestätigt, bringt aber auch neue, auf aktuellen Studien basierende Empfehlungen. Im Folgenden werden die wichtigsten Empfehlungen zusammengefasst.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf allgemeineplus.at und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. universimed.com & med-Diplom.at)
Aktuelle Evidenz aus klinischen, epidemiologischen und genetischen Studien belegt, dass die Ablagerung von LDL-Cholesterin (LDL) und anderen cholesterinreichen Apolipoprotein-B-haltigen Lipoproteinen in der Gefäßwand der Arterien eine zentrale Rolle bei der Entwicklung von Atherosklerose spielt.2 Das relative kardiovaskuläre Risiko steigt je 30mg/dl LDL um 30%.3 Gleichzeitig haben zahlreiche Studien gezeigt, dass durch LDL-Absenkung das Risiko in der Primär- wie der Sekundärprävention ebenfalls gesenkt werden kann. Aktuelle Studien konnten zudem belegen, dass durch eine besonders intensive LDL-Absenkung über die bislang empfohlenen Zielwerte hinaus das Auftreten kardiovaskulärer Ereignisse weiter zusätzlich verhindert werden kann.4,5 Aufgrund dessen wurden in den neuen Leitliniendie LDL-Zielwerte nach unten korrigiert und eine neue Risikostratifizierung festgelegt.
Neue Risikostratifizierung und Therapieziele
Im Mittelpunkt der Therapie steht das LDL-Cholesterin. Die Zielwerte sollten
auf das individuelle kardiovaskuläre Risiko des jeweiligen Patienten abgestimmt werden.1
Ein sehr hohes Risiko tragen
-
Patienten, die bereits an einer atherosklerotischen Krankheit, zum Beispiel KHK, CAVK oder PAVK leiden. Hierunter fallen auch Patienten mit Plaques in der Bildgebung (z.B. Carotis-Ultraschall)
-
Diabetikermit Endorganschaden, ≥3 Risikofaktoren oder einem T1DM mit >20 Jahren Dauer
-
Patienten mit schwerer Niereninsuffizienz (eGFR <30ml/min/1,73m2)
-
Patienten mit familiärer Hypercholesterinämie mit ASCVD oder einem weiteren Risikofaktor
-
aufgrund ihres Alters und/oder wegen Komorbiditäten ein SCORE(Systematic Coronary Risk Evaluation)-Ergebnis von ≥10% für ein fatales kardiovaskuläres Ereignis innerhalb der nächsten 10 Jahre haben.1
Als Hochrisikopatient gilt, wer
-
erhöhte einzelne Risikofaktoren (Gesamtcholesterin >310mg/dl, LDL >190mg/dl)
oder einen Bluthochdruck von ≥180/110mmHg hat -
Diabetes ohne Endorganschaden,eine Dauer >10 Jahren oder weitere Risikofaktoren aufweist
-
eine moderate Niereninsuffizienz (eGFR 30–59ml/min/1,73m2) aufweist
-
familiäre Hypercholesterinämie ohne Risikofaktoren hat
-
einen Risikoscore von ≥5 und <10% für ein fatales kardiovaskuläres Ereignis innerhalb der nächsten 10 Jahre hat
In der Allgemeinpraxis häufiger sind jedoch meist Patienten mit mittlerem oder geringem Risiko. Zu Patienten mit mittlerem Risiko zählen
-
junge Typ-1- (<35 Jahre) und Typ-2-Diabetiker (<50 Jahre)mit einer Dauer <10 Jahren ohne weitere Risikofaktoren
-
alle mit einem Risikoscore von ≥1 und <5% für ein fatales kardiovaskuläres Ereignis innerhalb der nächsten 10 Jahre
Patienten mit einem niedrigen Risiko sind alle mit einem Risikoscore von <1% für ein fatales kardiovaskuläres Ereignis innerhalb der nächsten 10 Jahre.1
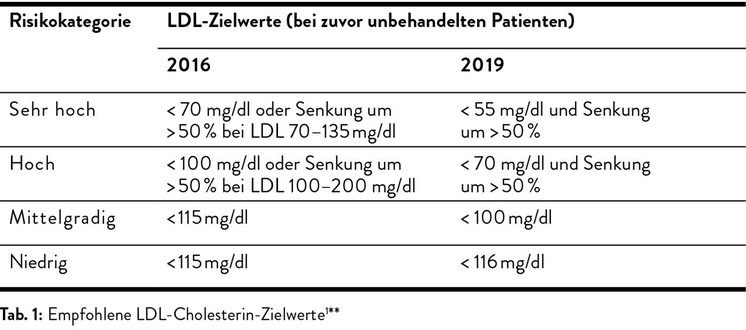
Die Zielwerte für die Gruppen mit mittlerem bis sehr hohem Risiko wurden in der aktuellen Fassung der Leitlinie gegenüber 2016 nochmals gesenkt (Tab. 1). Bei Patienten mit bekannter Atherosklerose und einem zweiten kardiovaskulären Ereignis innerhalb von zwei Jahren raten die aktuellen Leitlinien sogar dazu, eine LDL-Senkung auf <40mg/dl zu erwägen.1 Hintergrund dafür sind Daten aus Studien mit Ezetimib und PCSK9-Hemmern, die gezeigt haben, dass eine striktere LDL-Senkung mit einem signifikant niedrigeren kardiovaskulären Risiko verbunden ist.6, 7 Zudem sollte in der Primärprävention verstärkt mittels Carotissonografie oder Koronar-CT auf bestehende Gefäßkrankheiten untersucht werden.1
Medikamente und Therapiestrategien
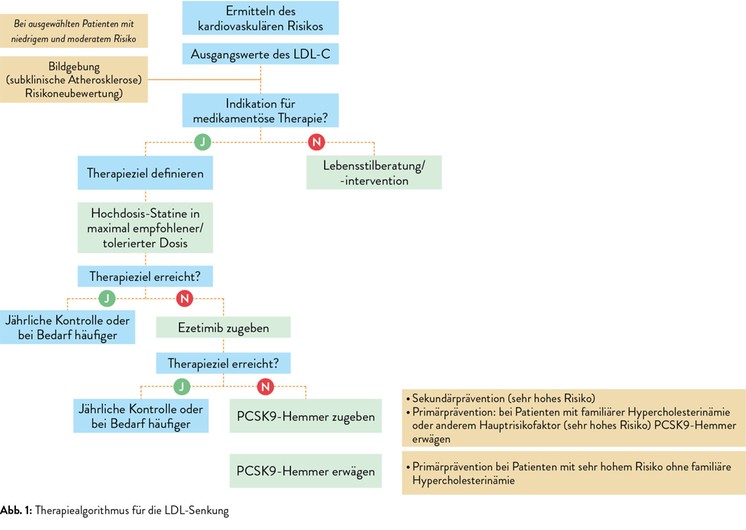
Die Basis jeder Lipidtherapie ist eine Lebensstiländerung hin zu einer ausgewogenen Ernährung, regelmäßiger Bewegung und Rauchstopp. Dies sollte auch Patienten mit niedrigem kardiovaskulärem Risiko geraten werden. Ist eine medikamentöse Therapie indiziert, sind die Statine, die die Cholesterinsynthese in der Leber hemmen, Medikamente der ersten Wahl. Bei Patienten mit erhöhtem kardiovaskulärem Risiko ist es empfehlenswert, direkt mit einem Hochdosisstatin wie Rosuvastatin oder Atorvastatin zu beginnen, das eine LDL-Senkung um 50 bis 55% bewirkt. Erst wenn die Statintherapie in der maximal tolerierten Dosierung nicht den gewünschten Effekt hat, empfehlen die Leitlinien als Zweitlinientherapie die Kombination mit Ezetimib. Ezetimib wirkt synergistisch zu den Statinen, indem es die Cholesterinresorption im Darm hemmt.1 Reicht auch die Zweitlinientherapie nicht aus, sollten bei Patienten mit sehr hohem kardiovaskulärem Risiko Proproteinkonvertase-Subtilisin/Kexin-Typ-9(PCSK9)-Hemmer eingesetzt werden. PCSK9-Hemmer sind monoklonale Antikörper, die alle 2 Wochen subkutan injiziert werden. Sie senken den LDL-Spiegel im Blut, indem sie den Abbau von LDL-Rezeptoren in den Leberzellen verhindern, wodurch mehr LDL aus dem Blut in die Leberzellen aufgenommen wird.1 Daten aus klinischen Studien belegen, dass die Zugabe von PCSK9-Hemmern zur Statintherapie, neben einer zusätzlichen Senkung des LDL-C von ca. 60%, auch das Auftreten von kardiovaskulären Ereignissen reduzieren kann.4, 5 Auch das Gesamtüberleben wird verlängert.5 Daher haben sie in der neuen Leitlinie eine 1A-Empfehlung bei Patienten mit sehr hohem kardiovaskulärem Risiko erhalten, die unter maximal tolerierter Statintherapie und Ezetimib ihren LDL-C-Zielwert nicht erreichen. Abbildung 1 zeigt den aktuellen leitliniengerechten Therapiealgorithmus und Tabelle 2 die durchschnittliche LDL-Reduktion unter den verschiedenen Therapien.

Immer wieder wird der Einsatz von Omega-3-Fettsäuren zur Behandlung von Dyslipidämien diskutiert. Nachdem 2018 mehrere Studien keinen Effekt zeigen konnten, hat eine aktuelle Untersuchung positive Daten geliefert. Allerdings wurde in dieser nicht Docosahexaensäure eingesetzt, sondern Eicosapentaensäure (EPA) in einer hohen Dosierung von 4g pro Tag.8 Die Resultate sind in die Leitlinien eingeflossen: Bei Hochrisikopatienten, die trotz adäquater Statintherapie erhöhte Triglyzeridwerte aufweisen, kann die Kombination eines Statins mit hoch dosierter EPA erwogen werden.1 Da jedoch derzeit keine so hoch dosierten Präparate in Österreich erhältlich sind, ist dies – auch aus Kostengründen – wenig realistisch. Von dem erhältlichen Präparat müssten die Patienten mindestens acht Kapseln einnehmen, was zu erheblichen Therapiekosten führen würde.
Anspruch und Wirklichkeit
Im klinischen Alltag werden allerdings schon die Zielwerte der alten Leitlinie nur bei etwa einem Drittel der Patienten erreicht.9 Die Ursachen dafür sind vermutlich vielfältig. Einerseits wird angenommen, dass Ärzte oft LDL-C-Werte über dem Zielbereich akzeptieren, weil sie entweder aus Angst vor Nebenwirkungen keine hoch dosierten Statine verordnen, die Therapie nicht regelmäßig überprüfen und anpassen oder die Statine nach Erreichen des Zielwertes wieder absetzen.10 Seitens der Patienten stehen oft mangelnde oder falsche Informationen ("Cholesterinlüge") und fehlendes Vertrauen zum Arzt, die Furcht vor Nebenwirkungen sowie Vergesslichkeit, vor allem bei Polymedikation, einer guten Cholesterineinstellung im Weg.10
Daher ist der erste Schritt eine umfassende Aufklärung der Patienten über die Bedeutung der Lipidtherapie für die kardiovaskuläre Gesundheit. Dann sollte von Anfang an, insbesondere bei Patienten mit sehr hohem kardiovaskulärem Risiko, ein Behandlungskonzept erstellt werden, beginnend mit einer Hochdosis-Statintherapie. Nach vier bis sechs Wochen sollte der Patient zur Kontrolle bestellt werden. Liegen die Werte dann nicht im Zielbereich, sollte gleich Ezetimib verordnet und der Patient erneut zur Kontrolle bestellt werden. Bei Patienten, bei denen aufgrund eines erhöhten LDL-C- Ausgangswerts davon ausgegangen werden kann, dass mit Statinen allein der Zielwert nicht erreicht werden kann, sollte der sofortige Beginn einer Kombinationstherapie angedacht werden.
Sind die Zielwerte auch dann noch nicht erreicht, ist die Gabe eines PCSK9-Hemmers indiziert (Abb. 1).10 Allerdings dürfen PCSK9-Hemmer in Österreich derzeit nur von ausgewählten endokrinologischen Zentren verordnet werden. Dafür gibt es vorgefertigtes Formblatt zum Download auf der Website der Österreichischen Gesellschaft für Endokrinologie und Stoffwechsel (ÖGES). Obwohl die Leitlinien für diese Patientengruppe ganz klar einen LDL-C-Zielwert von <55mg/dl empfehlen, erlauben die österreichischen Erstattungsregeln derzeit nur dann das Verschreiben eines PCSK9-Hemmers, wenn das LDL-C nach 3 Monaten unter der maximal tolerierten Kombinationstherapie (Atorvastatin/Rosuvastatin plus Ezetimib) noch >100mg/dl ist.
Mit dem vollständig ausgefüllten Formblatt und den aktuellen Laborbefunden muss der Patient sich bei einem der Zentren für die PCSK9-Hemmer Erstverordnung vorstellen. Diese sind auf der Website des Hauptverbands der Sozialversicherungen zu finden.
Literatur:
-
Mach F et al.: 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk. Eur Heart J 2019; doi: 10.1093/eurheartj/ehz455 [Epub ahead of print]
-
Ference BA et al.: Lowdensity lipoproteins cause atherosclerotic cardiovascular disease. 1. Evidence from genetic, epidemiologic, and clinical studies. A consensus statement from the European Atherosclerosis Society Consensus Panel. Eur Heart J 2017; 38: 2459-72
-
Grundy SM et al.: Implications of recent clinical trials for the National Cholesterol Education Program Adult Treatment Panel III guidelines. Circulation 2004; 110: 227-39
-
Sabatine MS et al.: Evolocumab and clinical outcomes in patients with cardiovascular disease. NEJM 2017; 376: 1713-22
-
Schwartz GG et al.: Alirocumab and Cardiovascular Outcomes after Acute Coronary Syndrome. N Engl J Med 2018; 379: 2097-107
-
Cannon CP et al.: Ezetimibe added to statin therapy after acute coronary syndromes. N Engl J Med 2015; 372: 2387-97
-
Robinson JG et al.: Efficacy and safety of alirocumab in reducing lipids and cardiovascular events. N Engl J Med 2015; 372: 1489-99
-
Bhatt DL et al.: Cardiovascular Risk Reduction with Icosapent Ethyl for Hypertriglyceridemia. N Engl J Med 2019; 380: 11-22
-
Kotseva K et al.: Lifestyle and impact on cardiovascular risk factor control in coronary patients across 27 countries: Results from the European Society of Cardiology ESC-EORP EUROASPIRE V registry. Eur J Prev Cardiol 2019; 26: 824-35
-
Huber K et al.: Praktische Umsetzung der Richtlinien zur LDL-C-Senkung 2017. J Kardiol 2017; 24: 94-100