DFP-Literatur: Gastroenterologie und Hepatologie
Häufige Fälle in der Praxis
In der täglichen Praxis stellen sich Patienten häufig mit gastrointestinalen Beschwerden vor. Auch erhöhte Leberwerte werden, etwa im Rahmen von Routineuntersuchungen, immer wieder festgestellt. In beiden Fällen gilt es, die Ursache gründlich abzuklären, da viele dieser Symptome unspezifisch sind und bei einer Vielzahl von Krankheiten gefunden werden können.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf allgemeineplus.at und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. universimed.com & med-Diplom.at)
Gastritis: Diagnostik und Therapie
Schmerzen im Oberbauch sind häufig, aber unspezifisch. Differenzialdiagnostisch kommen zahlreiche Krankheiten infrage, die man in drei Gruppen unterteilen
kann:
Krankheiten abdomineller Organe (Magen, Leber, Gallenblase, Bauchspeicheldrüse, Milz, Zwölffingerdarm, Dünn- und Dickdarm)
Krankheiten thorakaler Organe, die in das Epigastrium ausstrahlen, zum Beispiel Hinterwandinfarkt, Lungenembolie, Pleuritis, Pneumonie, Aneurysma dissecans
Systemkrankheiten (eher selten): akute Porphyrie, familiäres Mittelmeerfieber, Pseudoperitonitis diabetica, Urämie
Aufgrund der Vielfalt der infrage kommenden Ursachen umfasst die Diagnostik neben der körperlichen Untersuchung, bei der typischerweise ein Druckschmerz über dem Epigastrium ausgelöst werden kann, die üblichen Laboruntersuchungen (Blutbild, Serologie), eine Oberbauchsonografie und eine Gastroskopie. Bei der Sonografie ist darauf zu achten, ob die Bauchspeicheldrüse gut einsehbar ist. Ist dies nicht der Fall, müssen bei entsprechendem klinischem Verdacht weitere Untersuchungen eingeleitet werden. Die Gastroskopie liefert weitere Hinweise, zum Beispiel streifige oder fleckige Rötungen, Ulzera etc. Für die Diagnose "Gastritis" entscheidend ist jedoch letztlich der histologische Befund. Es sind daher zwingend Biopsien zu entnehmen. Eine Koloskopie ist häufig empfehlenswert, jedenfalls aber bei Menschen über 50 Jahre im Zuge der Krebsvorsorge. Besonders bei plötzlich auftretenden Oberbauchschmerzen sollte außerdem ein EKG angefertigt werden, um einen Hinterwandinfarkt auszuschließen.
Einteilung
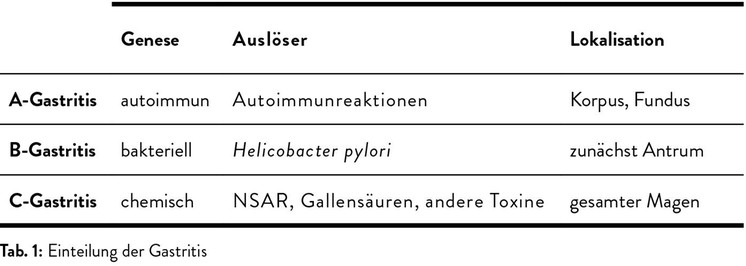
Bei der Gastritis werden anhand der Genese drei Hauptformen (A-, B- und C-Gastritis) unterschieden (Tab. 1).
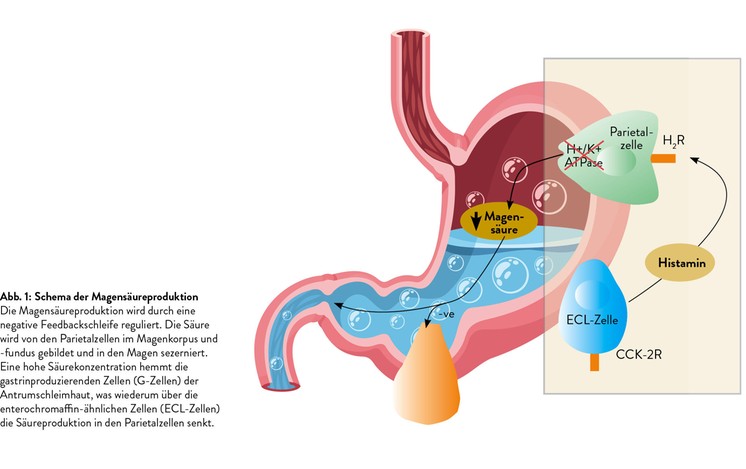
Bei der A-Gastritis verhindern autoimmune Prozesse die normale Regulation der Magensäureproduktion (Abb. 1), indem sie die Parietalzellen in der Korpusschleimhaut zerstören. Die Folge ist eine Hypoazidität, wodurch die hemmende Wirkung auf die gastrinproduzierenden G-Zellen entfällt. Die gesteigerte Gastrinausschüttung fördert die Proliferation der enterochromaffin-ähnlichen Zellen (ECL-Zellen). Daher haben Patienten mit A-Gastritis ein erhöhtes Risiko, ausgehend von den ECL-Zellen neuroendokrine Tumoren (Karzinoide) zu entwickeln. Eine weitere Folge der A-Gastritis ist ein Vitamin-B12-Mangel, da die Parietalzellen den "intrinsic factor" bilden, der für die Resorption dieses Vitamins essenziell ist. Unbehandelt führt dies zu einer makrozytären Anämie, zur Steigerung der LDH-Spiegel und zu neurologischen Symptomen wie schweren Sensibilitätsstörungen. Die Diagnose wird durch die Histologie und den Nachweis spezifischer Antikörper gegen die Parietalzellen bzw. gegen den "intrinsic factor" gesichert. Die Therapie besteht in einer parenteralen Vitamin-B12-Substitution. Zudem sollte wegen des erhöhten Tumorrisikos einmal pro Jahr eine Gastroskopie vorgenommen werden.
Die B-Gastritis wird durch Helicobacter pylori verursacht und weist ein charakteristisches histologisches Bild auf.1 Infektionen mit H. pylori sind weltweit verbreitet; insgesamt ist etwa die Hälfte der Menschheit damit infiziert.2 Die Infektion erfolgt in der Regel in der frühen Kindheit. Im Anschluss entwickelt sich eine chronisch-aktive Typ-B-Gastritis, die bei rund 90% der Infizierten nur geringe oder keine Beschwerden verursacht. Viele wissen daher nichts von ihrer Infektion. Etwa 10% der Betroffenen entwickeln Folgekrankheiten, unter anderem Ulzera, und nur sehr selten kommt es zu einem Magenkarzinom, noch seltener zu einem MALT-Lymphom, einer Unterart des Non-Hodgkin-Lymphoms, und anderen seltenen Gastritisformen.
Bei Patienten, die ein Magenkarzinom entwickeln, kommt es zunächst meist zu einer Atrophie der Magenschleimhaut und anschließend zu intestinalen Metaplasien. Daraus können gering- und später hochgradige Dysplasien entstehen, die zum Magenkarzinom fortschreiten.3
Die wichtigsten Auslöser einer C-Gastritis sind nichtsteroidale Antirheumatika (NSAR), weshalb diese Gastritisform sehr häufig ist. In der Anamnese gilt es herauszufinden, ob der Patient solche Medikamente einnimmt. Allerdings gestaltet sich dies nicht selten schwierig, da viele Menschen ihre regelmäßig eingenommenen Schmerzmittel nicht als Medikamente betrachten. Hier hilft oft mehrmaliges Nachfragen, zum Beispiel: "Haben Sie etwas gegen Rückenschmerzen, Kopfschmerzen o.Ä. eingenommen?" Therapeutisch sollte, wenn möglich, auf NSAR verzichtet werden oder, falls dies nicht gelingt, ein Protonenpumpeninhibitor (PPI) als Magenschutz verordnet werden.
Therapie der B-Gastritis
Es stellt sich zunächst die Frage, ob eine H. pylori-Eradikation bei einem konkreten Patienten überhaupt sinnvoll ist. Eindeutig zu bejahen ist dies bei Patienten, die bereits Ulzera in der Anamnese hatten. Von jenen, bei welchen noch nie ein gastroduodenales Ulkus festgestellt wurde und die lediglich unter geringen Beschwerden wie gelegentlichen Oberbauchschmerzen leiden, profitieren nur wenige von einer Eradikationstherapie, wie eine Cochrane-Metaanalyse zeigt.4 Der Grund ist, dass viele dieser Patienten gleichzeitig unter einem Reizmagensyndrom leiden und H. pylori nicht der primäre Auslöser der Symptome ist. Daher muss mit jedem Patienten über die Vor- und Nachteile einer Eradikationstherapie gesprochen und die Entscheidung darüber individuell getroffen werden.
Bis vor Kurzem wurden hauptsächlich Clarithromycin-basierte Tripelregime zur H. pylori-Eradikation eingesetzt. Allerdings wird das Bakterium zunehmend resistent gegen die Substanz, wie auch eine österreichische Studie zeigt: Sie ermittelte eine Resistenzrate von rund 21% gegen Clarithromycin und von rund 13% gegen Chinolone.5 Dies bedeutet, dass die bislang übliche Tripeltherapie aus Clarithromycin, Metronidazol bzw. Amoxicillin und einem PPI, die nur eine Woche lang verabreicht wird, nicht mehr verschrieben werden sollte (es sei denn, es wurde vor der Therapie eine Resistenztestung durchgeführt, die das Vorliegen eines gegenüber Clarithromycin sensiblen Stammes zeigte). Das Gleiche gilt für die sequenziellen Therapien, die entweder auf Clarithromycin oder Levofloxacin basieren.6,7 Stattdessen empfehlen aktuelle Konsensuspapiere eine Quadrupeltherapie aus Amoxicillin, Clarithromycin, Metronidazol und einem PPI mit einer Therapiedauer von 14 Tagen. In dieser Kombination können die anderen Antibiotika eine Clarithromycinresistenz überwinden. Allerdings geht diese Therapie auch mit stärkeren Nebenwirkungen einher, weshalb die Vor- und Nachteile sorgfältig gegeneinander abgewogen werden müssen.6, 7 Eine Alternative ist eine Quadrupeltherapie aus Bismut, Tetracyclin, Metronidazol und PPI über 10 bis 14 Tage.8 Allerdings ist diese Kombination in Österreich Chefarzt-pflichtig.
Zur Kontrolle, ob die Eradikation erfolgreich war, genügt in der Regel ein Atem- oder Stuhlantigentest. Hatte der Patient jedoch ein Magengeschwür, erfolgt die Kontrolle mittels Gastroskopie, um ein Magenkarzinom sicher auszuschließen.
Alkoholische und nichtalkoholische Fettleber
Eine Krankheit, die bereits jetzt in den Industriestaaten weit verbreitet ist und deren Inzidenz weiter steigen wird, ist die Fettleber (Steatosis hepatis). Als mögliche Ursachen kommen infrage:9
chronischer Alkoholmissbrauch (alkoholische Fettleber, AFL)
metabolisches Syndrom (nichtalkoholische Fettleber, NAFL)
Medikamente, Chemotherapie, Hepatitis-C-Virusinfektion, Fettstoffwechselstörungen, Mangelernährung etc. (sekundäre Fettleber)
Die Abgrenzung zwischen einer AFL und einer NAFL ist mitunter schwierig, da die hepatotoxische Alkoholwirkung individuell verschieden ist und auch AFL-NAFL-Mischformen vorkommen.10 Ist die Abgrenzung nicht möglich, dann spricht man von einer BAFL ("both alcoholic and non-alcoholic fatty liver"). Die höchste Prävalenz der NAFL ist bei den über 60-Jährigen zu finden und die Hauptrisikofaktoren sind Adipositas, Diabetes mellitus und Hyperlipidämie.9
Diagnostik
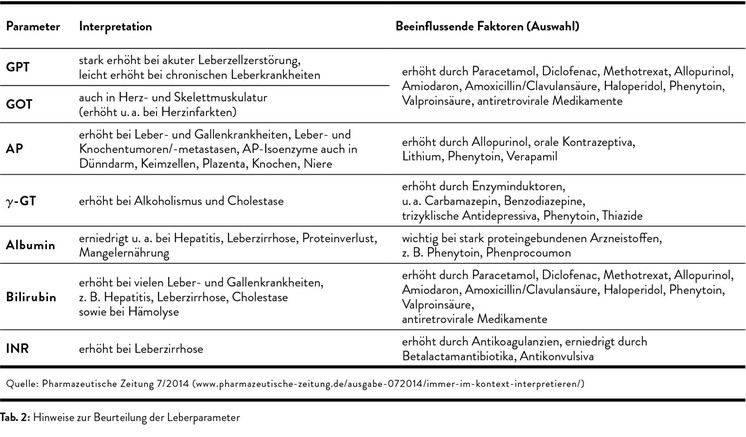
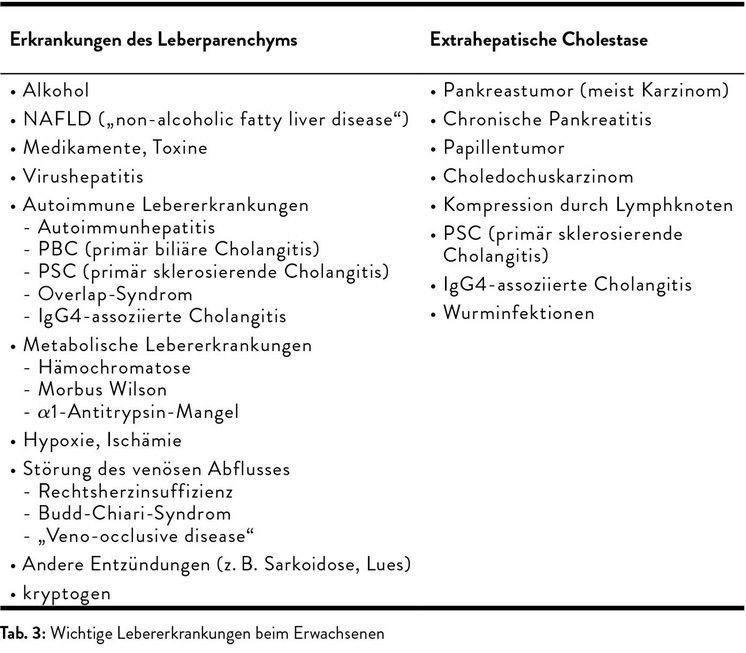
Neben der körperlichen Untersuchung werden die üblichen Laborwerte erhoben, wobei sich die routinemäßig bestimmten Leberwerte in drei Gruppen einteilen lassen: GOT, GPT und LDH sind sogenannte Nekroseparameter, die auf einen Zellzerfall hinweisen. Wichtig ist der De-Ritis-Quotient aus GOT/GPT. Liegt dieser über 1, so kann dies für einen alkoholischen Leberschaden sprechen. Die Cholestaseparameter alkalische Phosphatase (AP), Gamma-GT (γ-GT) und konjugiertes (direktes) Bilirubin zeigen an, ob der Gallenfluss funktioniert. Die dritte Gruppe sind die Syntheseparameter Albumin, Cholinesterase und die Gerinnungswerte. Sie sind immer dann vermindert, wenn die Leber ihre Synthesefunktion nicht mehr erfüllen kann, etwa im Fall einer fortgeschrittenen Zirrhose. Allerdings ist keiner der genannten Parameter spezifisch für eine Lebererkrankung, weshalb man sie immer im Kontext mit weiteren Befunden beurteilen muss (Tab. 2).11 Weitere wertvolle diagnostische Hinweise liefert eine Oberbauchsonografie. Tabelle 3 gibt einen Überblick über die wichtigsten Differenzialdiagnosen.
Progression und Prognose
Eine NAFL allein verläuft eher benigne, denn nur etwa 1 bis 3% der Patienten entwickeln im weiteren Verlauf eine Leberzirrhose. Bei der AFL sind es dagegen bis zu 20%. Schlechter wird die Prognose, wenn es zur Entzündung im Leberparenchymkommt, also zur ASH (alkoholische Steatohepatitis) oder NASH (nichtalkoholische Steatohepatitis) bzw. BASH bei nicht eindeutig abzugrenzenden Fällen.11 Vor allem die ASH hat eine ungünstige Prognose, da sie in bis zu 40% der Fälle zur Zirrhose fortschreitet; bei der NASH sind es bis zu 25% der Fälle (Abb. 2).
Therapie
Die NAFL ist grundsätzlich durch eine Lebensstilmodifikation heilbar. Die Empfehlungen sind die gleichen wie beim metabolischen Syndrom: Gewichtsabnahme, regelmäßige Bewegung, ausgewogene, fettarme Ernährung. Dies gilt auch für die AFL, bei der jedoch zudem die Alkoholkarenz notwendig ist. Allerdings sind gerade Lebensstilmodifikationen in der Regel schwierig umzusetzen, weshalb derzeit zahlreiche Substanzen mit unterschiedlichen Angriffspunkten zur Behandlung der NAFL/AFL in Entwicklung sind.
Literatur:
Warren JR, Marshall B: Lancet 1983; 1: 1273-5
Hooi JKY et al.: Gastroenterology 2017; 153: 420-9
Busuttil RA et al.: J Gastroenterol Hepatol 2009; 24: 193-201
Moayyedi P et al.: Am J Gastroenterol 2003; 98: 2621-6
Bilgilier C et al.: Clin Microbiol Infect 2018; 24: 267-72
Malfertheiner P et al.: Gut 2017; 66: 6-30
Fallone CA et al.: Gastroenterology 2016; 151: 51-69
Delchier JC et al.: Aliment Pharmacol Ther 2014; 40: 171-7
Roeb E et al.: Z Gastroenterol 2015; 53: 668-723
Diehl AM et al.: Gastroenterology 1988; 95: 1056-62
Neuschwander-Tetri BA, Caldwell SH: Hepatology 2003; 37: 1202-19