17. August 2021
Feinabstimmung des Therapiegeflechts beim Mammakarzinom
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf allgemeineplus.at und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. universimed.com & med-Diplom.at)
Eine Verbesserung der Patientenselektion und der Verträglichkeit des etablierten Armamentariums steht im Fokus vieler Forschungsprojekte rund um das Mammakarzinom. Aktuelle Einblicke gewährten Resultate klinischer Studien, die Anfang Mai im Rahmen des Breast Cancer Virtual Congress 2021 der Europäischen Gesellschaft für Medizinische Onkologie (ESMO) präsentiert wurden.
Beim Management von Patientinnen mit HER2(«human epidermal growth factor receptor 2»)-positivem Mammakarzinom wurde die (duale) HER2-Blockade mittlerweile bekanntermassen in allen Therapielinien etabliert. In der neoadjuvanten Situation stellt die Überbehandlung mit Chemotherapiekombinationen ein Thema dar. Es besteht ein Bedarf an Biomarkern, um Patientinnen mit frühem HER2-positivem Mammakarzinom für Deeskalationsstrategien selektionieren zu können.
RNA-Expression als Deeskalations-Tool
Die Phase-II-Studie WSG-ADAPT HER2+/HR– prüfte beim HER2-positiven und Hormonrezeptor(HR)-negativen Mammakarzinom die neoadjuvante Gabe von Trastuzumab (T) plus Pertuzumab (P) zusammen mit Paclitaxel im Vergleich zu T + P alleine über 12 Wochen. Durch die Zugabe von Paclitaxel konnte eine signifikante Steigerung der Rate an pathologischen Komplettremissionen (pCR) erreicht werden (90,5% vs. 36,3%).1 Im Mittelpunkt der am ESMO Breast Cancer 2021 vorgestellten Analyse stand der translationale Endpunkt der Studie, d.h. die Evaluierung der Assoziation zwischen RNA-Expressionssignaturen und stromalen tumorinfiltrierenden Lymphozyten (sTILs) mit der pCR und dem Überleben ohne invasive Erkrankung (iDFS).2
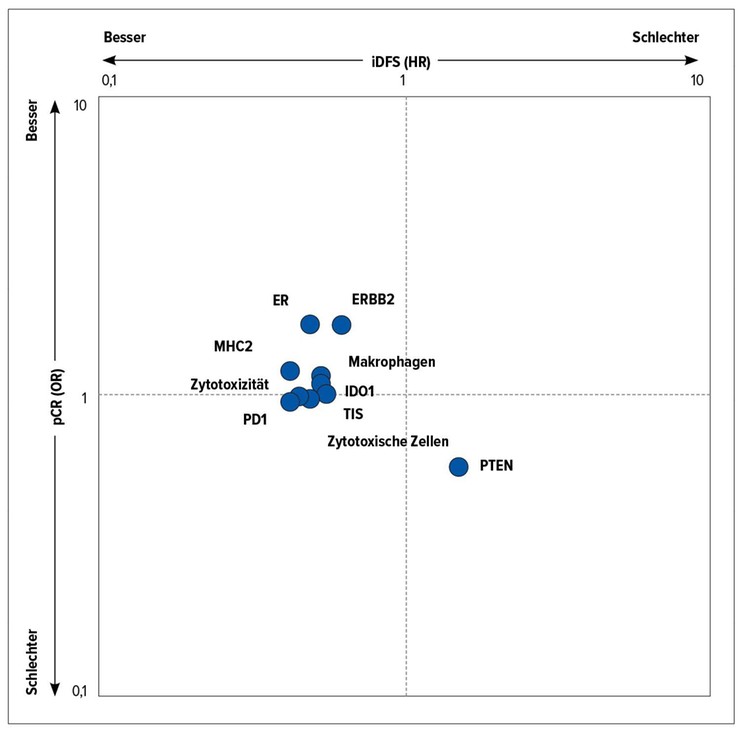
In beiden Studienarmen zeigten zehn Genexpressionssignaturen eine Assoziation mit pCR und/oder iDFS (Abb. 1). Keine signifikante Korrelation bestand dagegen zwischen sTILs und pCR oder iDFS. Die sTIL-Spiegel zu Studienbeginn korrelierten mit immunassoziierten Gensignaturen; Patientinnen, bei denen Letztere hochreguliert sind, könnten den Erkenntnissen zufolge Kandidatinnen für Deeskalationskonzepte beim HER2-positiven frühen Mammakarzinom sein. In der gesamten Kohorte schien die Aktivierung von immunassoziierten Genen und Pathways mit einer iDFS-Verlängerung einherzugehen. Derzeit wird ein chemotherapiefreies neoadjuvantes Konzept, das Pembrolizumab in Kombination mit der dualen HER2-Blockade bei HER2-positiven Tumoren beinhaltet, in der Phase-II-Studie Keyriched-1 untersucht.
Abb. 1: Assoziation von 10 Genexpressionssignaturen mit der pathologischen Komplettremission (pCR) und/oder dem Überleben ohne invasive Erkrankung (iDFS). Modifiziert nach Graeser et al.2
BERENICE: kardiale Sicherheit von T + P
Die multizentrische, nicht randomisierte Phase-II-Studie BERENICE zielte auf eine Erfassung der kardialen Sicherheit von T + P in der neoadjuvanten Situation ab. Patientinnen mit HER2-positivem Mammakarzinom und einer linksventrikulären Auswurffraktion (LVEF) ≥55% wurden in eine von zwei Kohorten eingeschlossen. Kohorte A (n=199) erhielt vier Zyklen dosisdichtes Doxorubicin/Cyclophosphamid gefolgt von vier dreiwöchentlichen Zyklen T + P und zwölf Zyklen Paclitaxel. In Kohorte B (n=201) kamen Fluorouracil, Epirubicin und Cyclophosphamid (FEC) gefolgt von T + P und Docetaxel zur Anwendung. Nach der Operation wurde T + P über 13 Zyklen verabreicht. Als primärer Endpunkt galt die Häufigkeit von Herzinsuffizienzepisoden NYHA III/IV sowie aller symptomatischen und asymptomatischen LVEF-Abfälle (≥10% ab Baseline bis zu einem Wert <50%) während der neoadjuvanten Therapie.
Die 2018 publizierte primäre Analyse erbrachte eine geringe Inzidenz kardialer Ereignisse bei hohen Ansprechraten.3 Nun wurde die endgültige Auswertung nach einem Follow-up von 64,5 Monaten präsentiert.4 Demnach blieb während des Beobachtungszeitraums die Inzidenz kardialer Ereignisse niedrig; im gesamten Studienverlauf entwickelten 1,5% (KohorteA) bzw. 1,0% (Kohorte B) eine Herzinsuffizienz NYHA III/IV. Zu LVEF-Abfällen kam es bei 13,6% bzw. 12,1%. Nebenwirkungen der Grade ≥3 manifestierten sich lediglich bei 1,0% bzw. 2,5%. In beiden Kohorten bildete die Progression der malignen Grunderkrankung die häufigste Todesursache.
Auch die onkologischen Ergebnisse konnten sich sehen lassen: Nach fünf Jahren waren in beiden Armen rund 90% der Patientinnen ereignisfrei, und mehr als 90% blieben über vier Jahre ohne invasive Erkrankung. Die 5-Jahres-Überlebensraten lagen bei 96,1% bzw. 93,8%. Insgesamt sprechen diese Daten für die neoadjuvante und adjuvante Therapie des HER2-positiven frühen Mammakarzinoms auf der Basis einer dualen HER2-Blockade in Kombination mit einer dosisdichten anthrazyklinbasierten Chemotherapie.
ShortHER: Trastuzumab über 9 Wochen
Die Therapie mit Trastuzumab über ein Jahr stellt beim HER2-positiven frühen Mammakarzinom bekanntermassen einen adjuvanten Behandlungsstandard dar. Dass nach einer nur neunwöchigen Therapie ein ähnlicher Benefit erreicht werden kann, implizierte die kleine FinHER-Studie.5 Auch finden sich unter Real-World-Bedingungen im Allgemeinen ein niedrigeres Rezidivrisiko bei einer substanziellen Wahrscheinlichkeit für kardiale Toxizitäten.6–10 Die an 82 italienischen Zentren durchgeführte ShortHER-Studie verglich daher bei Patientinnen mit HER2-positivem Mammakarzinom randomisiert die neunwöchige (n=626) mit der einjährigen (n=627) Therapiedauer. Im Prüfarm kam Trastuzumab parallel zu drei Docetaxel-Zyklen zum Einsatz; danach wurde das FEC-Schema über weitere drei Zyklen verabreicht.
Wie erhofft demonstrierte die Primäranalyse nach einem medianen Follow-up von 5,2 Jahren die Nichtunterlegenheit des verkürzten Anti-HER2-Regimes in Bezug auf das krankheitsfreie Überleben (DFS) bei gleichzeitig geringerer Rate an kardialen Nebenwirkungen (4,3% vs. 13,1%).11 Am ESMO Breast Cancer Congress wurden die aktualisierten Daten zu DFS und Gesamtüberleben vorgestellt.12 Für die Auswertung erfolgte die Einteilung der Patientinnen anhand von Tumorgrösse und Lymphknotenstatus in drei Risikokategorien.
Auch auf lange Sicht unterschied sich das DFS zwischen den beiden Armen nicht; nach fünf Jahren lagen die Raten im Prüfarm bei 85,8% und im Kontrollarm bei 87,9% (HR: 1,09). Ebenso verliefen die Kurven zum Gesamtüberleben deckungsgleich, und nach fünf Jahren lebten jeweils 95,1% der Patientinnen (HR: 1,18). Nur bei Teilnehmerinnen mit hohem Risiko erwies sich die lange T-Gabe in Bezug auf die beiden Endpunkte als überlegen; dagegen wurden bei jenen mit niedrigem und intermediärem Risiko, die 84% der Gesamtpopulation ausmachten, deckungsgleiche Kurvenverläufe verzeichnet. Wie die Autoren zusammenfassend festhalten, kommt die Deeskalation bei einem grossen Teil der Real-World-Population mit HER2-positivem frühem Mammakarzinom infrage.
ET-Benefits nach 20 Jahren
Angesichts der ungünstigen Langzeitprognose prämenopausaler Patientinnen prüfte eine Analyse der randomisierten Studie STO-5 den Benefit einer endokrinen Therapie (ET) nach Stratifizierung anhand der 70-Gen-Risikoprädiktionssignatur.13 In STO-5 waren zwischen 1990 und 1997 insgesamt 924 Patientinnen randomisiert mit Goserelin, Tamoxifen oder Goserelin plus Tamoxifen behandelt worden. Der Kontrollarm erhielt keine ET. 465 Frauen, die anhand der 70-Gen-Signatur in Gruppen mit niedrigem bzw. hohem Rezidivrisiko eingeteilt wurden, gingen in die Analyse ein. Mittlerweile überblickt die Studie auf Basis der hochqualitativen schwedischen Nationalregister eine Beobachtungszeit von 20 Jahren.
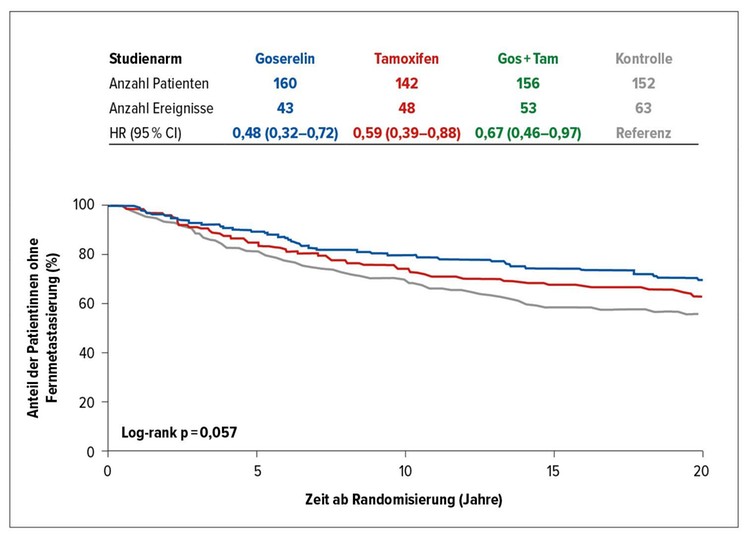
In diesem Zeitraum reduzierte die ET gegenüber dem Kontrollarm das Risiko für eine Fernmetastasierung um 52% (Goserelin), 41% (Tamoxifen) bzw. 33% (Goserelin plus Tamoxifen) (Abb. 2). Gemäss der 70-Gen-Risikostratifikation profitierten Patientinnen mit hohem Risiko speziell von Goserelin (HR: 0,22), während jene mit niedrigem Risiko besonders gut mit Tamoxifen fuhren (HR: 0,38). Der Tamoxifen-vermittelte Benefit in der Niedrigrisikogruppe wurde erst nach ca. 10 Jahren evident. In der Kombinationsgruppe resultierten keine signifikanten Benefits gegenüber der Kontrollgruppe; dies traf auf beide Risikokollektive zu. Bei Hochrisikopatientinnen bewirkte Goserelin als Monotherapie eine Risikoreduktion um 67% im Vergleich zur Kombination und um 70% vs. Tamoxifen.
Abb. 2: Reduktion des Risikos für das Auftreten von Fernmetastasen im Verlauf von 20 Jahren unter endokriner Therapie. Modifiziert nach Johansson et al.13
Neoadjuvante CDK4/6-Inhibition
Negative Ergebnisse erbrachte die randomisierte, non-komparative Phase-II-Studie UNICANCER-NeoPAL, die neoadjuvantes Letrozol plus Palbociclib mit FEC plus Docetaxel verglich. Hier stand die Intention im Vordergrund, die (neo)adjuvante Chemotherapie bei ausgesuchten Patientinnen mit frühem HR-positivem, HER2-negativem Mammakarzinom durch den CDK(«cyclin-dependent kinase»)4/6-Inhibitor Palbociclib zu ersetzen. In die beiden Studienarme gingen jeweils 53 postmenopausale Frauen im Stadium II/III mit Luminal-B-Tumoren oder lymphknotenpositiven Luminal-A-Tumoren ein.
Wie die 2018 publizierten Ergebnisse zeigten, resultierte kein signifikanter Unterschied im Hinblick auf pCR, klinisches Ansprechen und Brusterhaltungsraten.14 Delaloge et al. stellten nun die Ergebnisse zum progressionsfreien Überleben (PFS) und iDFS nach drei Jahren vor.15 Im Bereich dieser beiden Endpunkte wurden ebenfalls keine signifikanten Unterschiede festgestellt (HR: 1,01 bzw. 0,83). Nach 40 Monaten waren 86,7% vs. 87,2% der Patienten unter Palbociclib/Letrozol bzw. Chemotherapie progressionsfrei, was in dieser Hochrisikopopulation einem guten Outcome entspricht. Sehr geringe Ereignisraten schränkten die PFS-Auswertung je nach «residual cancer burden» ein. Den Autoren zufolge reicht die Power der Studie für definitive Schlussfolgerungen nicht aus, allerdings könnte der chemotherapiefreie neoadjuvante Zugang in spezifischen Fällen eine Option darstellen und verdient eine weitere Erforschung.
Datopotamab-Deruxtecan bei TNBC
Bei Patientinnen mit rezidiviertem/refraktärem fortgeschrittenem oder metastasiertem tripelnegativem Mammakarzinom (TNBC) sind die Outcomes bekanntermassen ungünstig. In diesem Setting evaluierte die Dosiseskalations- und -expansionsstudie TROPION-PanTumor01 das Antikörper-Wirkstoff-Konjugat Datopotamab-Deruxtecan (Dato-DXd), das gegen das Trophoblasten-Zelloberflächenantigen 2 (TROP2) gerichtet ist. Die Teilnehmerinnen hatten unter der Standardtherapie ein Rezidiv bzw. eine Progression erlitten und waren im Hinblick auf die TROP2-Expression unselektiert. Am ESMO Breast Cancer präsentierten Bardia et al. die Daten von 24 Patientinnen, von denen 22 mit 6mg/kg und zwei mit 8mg/kg behandelt wurden.16 Bei 88% waren bereits mindestens zwei Vortherapien zur Anwendung gekommen.
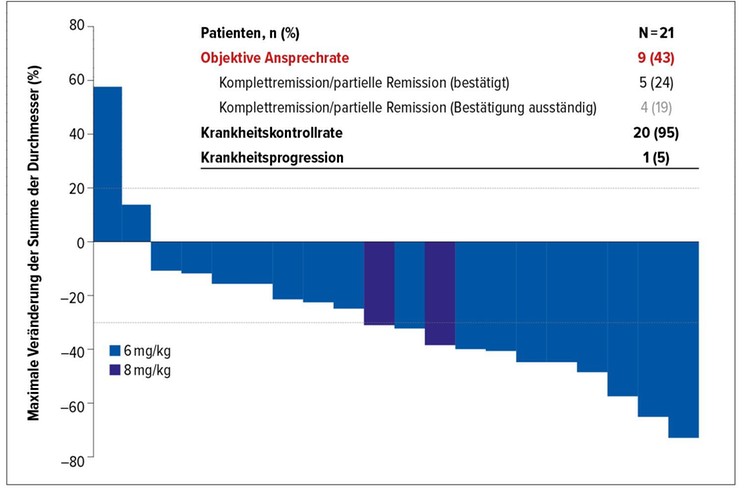
Als primäre Studienziele galten Sicherheit und Verträglichkeit von Dato-DXd in dieser massiv vorbehandelten Population. Die Substanz zeigte ein vertretbares Sicherheitsprofil. Unter den Nebenwirkungen überwogen Stomatitis, Übelkeit und Müdigkeit der Schweregrade 1 und 2. Dosisreduktionen wurden bei 25% notwendig, während es zu keinen nebenwirkungsbedingten Therapieabbrüchen kam. Im Bereich der Antitumoraktivität fiel eine objektive Ansprechrate von 43% auf, und die Krankheitskontrollrate betrug 95% (Abb. 3). Weitere Untersuchungen befinden sich im Laufen, derzeit wird eine Hormonrezeptor-positive Kohorte rekrutiert.
Abb. 3: Antitumoraktivität von Datopotamab-Deruxtecan in TROPION-PanTumor01. Modifiziert nachBardia et al.16
IO-Wirksamkeitssignale: GELATO
Basierend auf der Beobachtung, dass invasive lobuläre Karzinome (ILC) Merkmale aufweisen, die sie für eine Immuntherapie prädisponieren, prüfte die einarmige Phase-II-Studie GELATO bei Patientinnen mit metastasiertem ILC die Gabe von Atezolizumab.17 Nach maximal zwei Linien einer palliativen Chemotherapie kamen zwölf Zyklen Carboplatin zum Einsatz, wobei ab dem dritten Zyklus Atezolizumab bis zur Progression zugegeben wurde. Als primärer Endpunkt galt die PFS-Rate nach sechs Monaten. Bei fünf von 21 auswertbaren Patientinnen lag Tripelnegativität vor.
Die objektive Ansprechrate belief sich auf 19% und die klinische Benefitrate auf 29%. Das mediane PFS betrug 14,6 Wochen, und vier Patientinnen waren nach 6 Monaten progressionsfrei (17,4%). Vier der sechs Frauen, die von der Therapie profitierten, waren an einem tripelnegativen Karzinom erkrankt. Wie die translationalen Begleituntersuchungen zeigten, korrelierten stromale TILs und die Anzahl der CD8+ Zellen nicht mit dem klinischen Benefit, für die PD-L1-Expression auf den Immunzellen bestand dagegen ein Trend. PD-L1-Positivität lag insgesamt bei fünf Patientinnen vor, von denen drei klinisch profitierten. Weitere translationale Forschungen wären nach Einschätzung der Autoren erforderlich, um eine Rationale für innovative Strategien und die Verbesserung der Immuntherapie beim ILC zu kreieren.