DFP-Literatur
Das diabetische Fußsyndrom
Oft liegt die Herausforderung bei Diabetespatienten in der optimalen Einstellung ihrer Therapie. Präventionsmaßnahmen sind das Um und Auf, um das Auftreten von Komplikationen im Krankheitsverlauf zu minimieren und ein diabetisches Fußsyndrom (DFS) erst gar nicht aufkommen zu lassen. Welche Risiken die Diagnose des DFS allerdings mit sich bringen kann und worauf bei einem richtigen Case Management geachtet werden muss, erklärte Dr. Adalbert Strasser, Wien, im Rahmen des ALLGEMEINE+ Herbstquartetts 2020.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf allgemeineplus.at und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. universimed.com & med-Diplom.at)
Die International Diabetes Foundation (IDF) verkündete 2019, dass weltweit 463 Millionen Menschen an Diabetes erkrankt sind. In Österreich sind knapp 650 000 Menschen betroffen,1 wobei die Dunkelziffer auf 800 000 geschätzt wird. Nur 13% der Diabeteserkrankten in Österreich sind in eine strukturierte Diabetesversorgung eingebunden. Daher ist es nicht verwunderlich, dass über die gesamte Lebensdauer eines Diabetespatienten die Wahrscheinlichkeit, ein Ulkus bzw. ein diabetisches Fußsyndrom zu entwickeln, bei 19 bis 34% liegt.2 Nahezu zwei Drittel aller durchgeführten Amputationen in Österreich werden bei Menschen mit Diabetes durchgeführt – jährlich sind das in absoluten Zahlen 2500 bis 3000 Amputationen.3, 4 Dem interprofessionellen Management von Menschen mit Diabetes sollte demnach zukünftig ein höherer Stellenwert zugeschrieben werden.
Komplikationen: das diabetische Fußsyndrom
Durch die Unterdiagnostizierung von Menschen mit Diabetes bzw. eine inadäquate Therapieeinstellung kann es im Verlauf der Erkrankung zu verschiedensten lebenseinschränkenden bis hin zu lebensbedrohlichen Komplikationen kommen.5 Das diabetische Koma, die Retinopathie sowie die diabetische Nephropathie zählen beispielsweise dazu. Als eine der schwerwiegendsten Folgeerkrankung des Diabetes mellitus tritt das diabetische Fußsyndrom (DFS) auf.5 Dieses zeichnet sich durch Ulzerationen am Fuß (distal vom Knöchel und einschließlich des Knöchels) aus, die mit Neuropathie und unterschiedlichen Graden von Ischämie und Infektion verbunden sind – Faktoren, die das Risiko für eine Amputation des Fußes massiv steigern.6
Pathophysiologie des DFS
Bei Diabetikern sind von vornherein an den Füßen meist Faktoren vorhanden, die das Auftreten eines DFS fördern. Zu diesen Risikofaktoren zählen die Neuropathie, die periphere arterielle Verschlusskrankheit (PAVK), Verletzungen am Fuß (oft durch ungeeignetes Schuhwerk), Fußdeformitäten und eingeschränkte Gelenksmobilität sowie Hornhautschwielen. Auch biopsychosoziale Faktoren wie Depressionen, Vernachlässigung, fehlendes Krankheitsbewusstsein und Mangel an sozialer Unterstützung können die Entwicklung des DFS begünstigen.
Bei mehr als 90% der Fußulzerationen besteht eine periphere diabetische sensomotorische Neuropathie, es wird davon ausgegangen, dass bei mindestens 50% eine periphere arterielle Verschlusskrankheit ursächlich beteiligt ist, häufig finden sich auch Überschneidungen.7
Neuropathien
In der Pathophysiologie der diabetischen Neuropathien spielen mehrere Faktoren zusammen: die Störung der Mikrozirkulation, die Beeinträchtigung des Mitochondrien- und Fettstoffwechsels, die Aktivierung alternativer Stoffwechselwege, aber auch die Bildung neurotoxischer glykierter Proteine.8
Vom Allgemeinmediziner können bestehende Risikofaktoren für die Entwicklung einer Neuropathie gut erhoben werden. Schon in der klassischen Anamnese lassen sich Risikofaktoren wie beispielsweise Adipositas, Alkohol- und Nikotinkonsum, Verhältnis von Körpergröße, Körpergewicht und Alter sowie der Lebensstil und die körperliche Aktivität erfragen.
Die sensomotorische Neuropathie umfasst das klinische Bild einer motorischen sowie einer sensorischen Neuropathie. Die motorische Neuropathie führt zu einem Ungleichgewicht zwischen Flexoren und Extensoren und damit zu Deformitäten im Bereich des Fußes.7 Typische Symptome umfassen Schwäche, Muskelschwund, aber auch Muskelkrämpfe.7 Die sensorische Neuropathie zeichnet sich durch Pelzigkeits- und Taubheitsgefühle sowie Kribbel-, Wärme- und Kälteparästhesien aus. Die Schmerz- und Bewegungsempfindung ist eingeschränkt. Betroffene Patienten berichten darüber hinaus über Brennschmerz, Stechen, Gangunsicherheit und vermehrte Stürze.9 Oft nimmt der Patient seine Füße nicht mehr als Teil seines eigenen Körpers wahr, sondern als Umgebungsfaktor, was gemeinhin auch als „Leibesinselschwund“ bezeichnet wird.10
Auch die autonome Neuropathie kann ein diabetisches Fußsyndrom begünstigen. Sie zeichnet sich u. a. durch trockene und rissige Haut aus, die nur wenig widerstandsfähig gegenüber Traumen ist und somit eine ideale Eintrittspforte für Infektionserreger bildet.9
Periphere arterielle Verschlusskrankheit
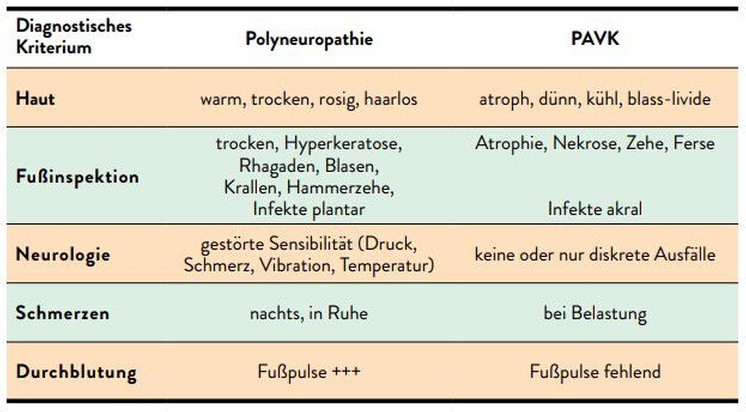
Die PAVK ist ein atherosklerotisch bedingter Durchblutungsmangel der peripheren Arterien und betrifft vorwiegend die unteren Extremitäten.11 Die Haut zeigt sich atroph, dünn und kühl, bei einer Fußinspektion können Atrophien und akrale Nekrosen beobachtet werden.
Die Symptome der Minderdurchblutung offenbaren sich vornehmlich bei Belastung, wenn die Muskulatur des Bewegungsapparates zur Funktion mehr Sauerstoff als in Ruhe benötigt. Aufgrund der Ischämie kommt es im Muskel zur Ausschüttung von Laktat und dadurch zu Schmerzen.11 In Abhängigkeit von der Schwere der Durchblutungsstörung werden die klinischen Symptome der PAVK in vier Gruppen nach der Einteilung von Fontaine zugeordnet (Tab. 1).11 Bei diabetischen Patienten ist hier allerdings Vorsicht geboten: Da diese meist zusätzlich unter einer mit fehlendem Schmerzempfinden assoziierten Neuropathie leiden, liegt bei diesen Patienten oft keine klassische Claudicatio-intermittens-Symptomatik vor.
Tab. 1: Stadien der PAVK: Schweregradeinteilung nach Fontaine (modifiziert nach Immanuel Albertinen
Diakonie/Albes J)10
Diagnostik
Die diagnostischen Maßnahmen zur Identifizierung eines DFS umfassen die Anamnese, Untersuchungen auf das Vorliegen einer diabetischen Neuropathie bzw. einer PAVK sowie die Inspektion des Fußes und der Schuhe.7
In der Anamnese sprechen symmetrische Schmerzen und Parästhesien, die vorwiegend bei Ruhe und/oder nachts auftreten, sowie eine gestörte Sensibilität (Druck, Schmerz, Vibration, Temperatur) bei meist gut tastbaren Fußpulsen für das Vorliegen einer diabetischen Neuropathie.7 Neurophysiologische Untersuchungen helfen bei der Quantifizierung der Neuropathie.7Eine motorische Neuropathie offenbart sich bei Diabetikern oft durch Fußform veränderungen wie z.B. Krallenzehen, die aus der Atrophie der kleinen Zehenmuskeln – verursacht durch die Schädigung des verantwortlichen Nervs – resultieren. Es kommt zur dauerhaften Inaktivität dieser Muskelgruppe, was bei der Belastung des Fußes zur Verlagerung des Druckmaximums unter die Mittelfußköpfchen führt. Das Gewebe wird dort wiederholt überbelastet (repetitiver Stressfaktor) und das Risiko für die Entwicklung eines neuropathischen Ulkus (Malum perforans) oder eines DFS steigt.
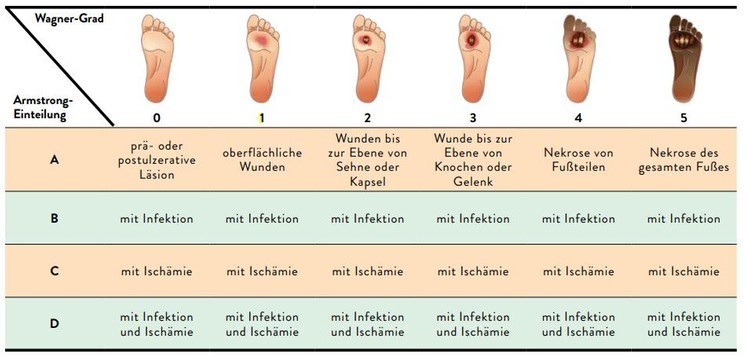
Anhand der in Tabelle 2 angeführten Merkmale kann eine PAVK von einer diabetischen Neurpathie unterschieden werden.7 Bei PAVK-Patienten treten Schmerzen bei Belastung auf und die Fußpulse fehlen. Durch Verschlussdruckmessungen (ABI) können Verengungen recht präzise eingegrenzt werden, ergänzend kommen Ultraschall, CT und MRT zum Einsatz. Jede Methode hat jedoch bei Menschen mit Diabetes ihre Einschränkungen. Den Goldstandard der PAVK-Diagnostik stellt nach wie vor die Angiografie dar, da so auch Verengungen in sehr kleinen Gefäßen lokalisiert und quantifiziert werden können.11 Eine angiografische Abklärung wird allerdings meist nur noch in Bereitschaft zur endovaskulären Rekanalisation durchgeführt. Für das weitere therapeutische Vorgehen bei einem bereits bestehendem Ulkus ist außerdem dessen Klassifikation entscheidend. Obwohl sich weltweit keine einheitliche Klassifikation durchsetzen konnte, ist in Europa die Einteilung nach dem Stufenschema nach Wagner und Armstrong üblich (Tab. 3).12, 13
Tab. 2: Diagnostische Unterscheidungen zwischen dem neuropathischen und dem ischämischen Fuß (modifiziert nach Lechleitner M et al. 2019)7
Tab. 3: Klassifikation von Ulzerationen nach Wagner und Armstrong (modifiziert nach Wagner FW 1981 und Armstrong DG et al. 1998)8, 12
Prävention und Therapie
Mindestens einmal jährlich sollte beim Diabetiker eine Fußuntersuchung erfolgen, die eine ausführliche Anamnese, Inspektion, Neuropathie- und Gefäßstatusprüfung der unteren Extremitäten sowie eine Schuhinspektion umfassen sollte. Besteht bereits eine Neuropathie, bedarf es einer regelmäßigeren Inspektion der Füße in einem Zeitabstand von drei bis sechs Monaten. Nach dem Motto „Schweigt der Fuß, schweigt auch der Patient!“ muss das Risiko für ein diabetisches Fußsyndrom vom betreuenden Diabetesteam eingeschätzt werden, die zeitlichen Abstände für Kontrolltermine müssen festgelegt (Tab. 4) und dem Patienten strikt vorgegeben werden.10
Um über die Dauer der Erkrankung hinweg Veränderungen an Gefäßen und Nerven vorzubeugen, ist eine gute Stoffwechselkontrolle wichtig.
Der Entwicklung eines DFS kann durch die Verordnung von speziellem Schuhwerk oder Einlagen vorgebeugt werden – eine gesunde Biomechanik des Fußes wird durch die richtige Druckverteilung unterstützt. Da die Compliance der Patienten für den Krankheitsverlauf wesentlich ist, sollten betroffene Patienten vorab ausführlich über ihre Erkrankung aufgeklärt werden und entsprechend geschult werden. Liegt z.B. eine manifeste Neuropathie vor, sollten Patienten Risiken für unerkannte Fußläsionen zu vermeiden wissen (kein Barfußlaufen, keine Heizdecken, Fußinspektion).7
Das Therapieziel bei einem DFS sollte immer individuell je nach Begleiterkrankungen und Lebensumständen festgelegt werden. Dabei können die Erhaltung der Mobilität, Infektions- und Amputationsvermeidung im Vordergrund stehen. Bei einem bereits vorliegenden diabetischen Ulkus ist die Abheilung desselben oft aber nicht immer das oberste Therapieziel, wobei die absolute Druckentlastung dabei im Mittelpunkt steht. Der Goldstandard in der Druckentlastung ist nach wie vor der Gips, aber auch Waben-Einlegesohlen, Kunststofforthesen und Langzeitverbandschuhe haben sich bewährt. Obsolet ist die Verwendung eines Vorfußentlastungsschuhes, da hierfür spezielle Gehtechniken vom Patienten erlernt werden müssen und das Risiko für einen Sturz deutlich erhöht ist.
Die Wundversorgung des Ulkus kann aktiv durch eine gezielte und wiederholte mechanische Reinigung als auch passiv durch Wundauflagen erfolgen. Die richtige Wahl der Wundauflage ist eine eigene Wissenschaft, daher gehört in diesem Gebiet entsprechend ausgebildetes Pflegepersonal zum Grundgerüst eines behandelnden Teams. Gemeinsam mit der mechanischen Wundreinigung sollte ein Antiseptikum zur Dekontamination von Erregern verwendet werden, die richtige Einwirkzeit – zwischen 2 und 20 Minuten je nach Indikation – gilt es dabei unbedingt einzuhalten.14 Beim Befall mit Keimen sollte die Nassphase 8 bis 10 Minuten andauern. Es liegt im Ermessen des Arztes, ob die Wunde dadurch ausreichend gereinigt werden kann. Auf jeden Fall gilt es eine Infektion rechtzeitig zu erkennen und gegebenenfalls antibiotisch zu behandeln, da bei jeder Infektion – und besonders bei tiefen Wunden – in weiterer Folge eine Osteomyelitis auftreten kann. Bei Verdacht sollte das Vorliegen einer Osteomyelitis mittels Röntgen bzw. MR abgekärt werden.7
Wenn indiziert, können mit chirurgischen oder mechanischen Maßnahmen die Entfernung von avitalem Gewebe und die Eröffnung von Wundtaschen erfolgen, bis intakte anatomische Strukturen sichtbar werden. Als weitere Therapieoptionen stehen Clostridienpeptidase, Hydrogele, Alginate, Madentherapie oder medizinischer Honig zur Verfügung. Mittels Revaskularisierungsmaßnahmen, wie gefäßchirurgischer Maßnahmen (Bypass) oder einer endovaskulären Rekanalisation mit Stent, kann die Durchblutung verbessert werden.
Spezialfall Charcot-Fuß
Unter dem Charcot-Fuß, einer schweren Komplikation des Diabetes mellitus und Sonderform des DFS, versteht man eine destruktive und progrediente Degeneration des Fußskelettes, der Fußgelenke und des Bandapparates. Die Ursachen sind nicht genau bekannt, allerdings wird von einer primär nicht infektiösen Ursache ausgegangen. Im Rahmen der neurotrophischen bzw. der neurotraumatischen Theorie werden eine neurogene Knochendystrophie bzw. unbemerkte Frakturen als ursächlich angenommen.15 Äußerlich fällt ein geschwollener, geröteter und überwärmter Fuß auf. CT und Röntgen sind im Anfangsstadium oft noch unauffällig. Lediglich im MRT können Knochenmarksödeme sichtbar werden. Dem Patienten fehlt auch hier jegliche Schmerzempfindung, wodurch die notwendige Entlastung des Fußes durch den Patienten ausbleibt. Daraus resultierende Gelenksschädigungen, Luxationen, Frakturen und Deformitäten führen zu einer vermehrten Instabilität des Fußes; das Risiko, ein Ulkus zu entwickeln, liegt bei 5 bis 10%.
Erhält ein Diabetiker die Diagnose Charcot-Fuß, erhöht sich die Wahrscheinlichkeit für eine Amputation stark. Es ist daher ratsam, Patienten bereits beim geringsten Verdacht zu einer Abklärung zu schicken. Die einzige mögliche Therapie ist eine konsequente Ruhigstellung, welche wenn möglich mit einem Gips durchgeführt werden sollte. Zur chirurgischen Stabilisierung der betroffenen Knochen können Osteosyntheseverfahren eingesetzt werden. Auch durch den operativen Eingriff ist ein längerfristiges günstiges Endresultat nur begrenzt möglich, da es durch die permanente Druckbelastung am Fuß zur Beschädigung verwendeter Schrauben kommen kann
Fazit
Bei der Diagnose diabetischer Fuß steht das Case Management an oberster Stelle. Sobald ein Ulkus beim Patienten auftritt, steigt das Risiko für eine zukünftige Amputation stark an, die Präventionsstrategien müssen daher gut organisiert und koordiniert werden. Eine optimale Versorgung des diabetischen Fußsyndroms schöpft alle therapeutischen Ebenen aus. Ein entsprechendes Wundnetzwerk kann eine optimale Versorgung von Patienten mit chronischen Wunden gewährleisten. Das klare Ziel dabei ist, die Amputationsrate zu senken.
Auch die Telemedizin wird zukünftig einen wichtigen Beitrag leisten, da klinische Evaluierungsprozesse durch eine standardisierte Wunddokumentation und schnelleren Datentransfer erleichtert werden können. Sie bietet neue Möglichkeiten für die interdisziplinäre Zusammenarbeit von Arzt und Pflege – für die Optimierung der Wundversorgung in Österreich können dementsprechend noch einige Schritte getätigt werden.
Bericht:
Vera Weininger, BA, Dr. Katrin Spiesberger
Quelle:
„Diabetischer Fuß: Wundversorgung und Diabetesbetreuung“, Vortrag von Dr. Adalbert Strasser beim ALLGEMEINE+-Herbstquartett am 12. September 2020 in Wien
Literatur
International Diabetes Federation: IDF diabetes atlas - 9th edition. 2019; 9: 1-176
Ibrahim A et al.: IDF clinical practice recommendations on the diabetic foot. 2017; www.idf.org/iabetes/54-our-activities/222-idf-clinical-practicerecommendations-on-the-diabetic-foot.html ; zuletzt aufgerufen am 2. 2. 2021
Kaser S et al.: Zahlen und Fakten zu Diabetes mellitus. www.facediabetes.at/zahlen-und-fakten.html ; zuletzt aufgerufen am 2. 2. 2021
Morbach S et al.: Diabetisches Fußsyndrom. Diabetologie 2017; 12(Suppl 2): 181-9
Rümenapf G et al.: Diabetisches Fußsyndrom - Teil 1. Der Chirurg 2021; 1: 81-94
Van Netten et al.: Definitions and criteria for diabetis foot disease. Diab Metab Res Rev 2020; e3268
Lechleitner M et al.: Diabetische Neuropathie und diabetischer Fuß. Wien Klin Wochenschr 2019; 131 (Suppl 1): 141-50
Feldman EL et al.: New horizons in diabetic neuropathy: mechanisms, bioenergetics, and pain. Neuron 2017; 93: 1296-313
Sommer C et al.: Polyneuropathien. Deutsches Ärzteblatt 2018; 115(6): 83-90
Risse A: Diabetologie in Wissenschaft und Praxis: Bemerkungen des neophänomenologisch beunruhigten Laien. In: Neue Phänomenologie. Symptom und Phänomen: Phänomenologische Zugänge zum kranken Menschen. München: Verlag Karl Alber Freiburg, 2006. 302-25
Immanuel Albertinen Diakonie (Albes J): Periphere Arterielle Verschlusskrankheit. herzzentrum.immanuel.de/herzzentrum-brandenburg-bei-berlin-leistungen/krankheitsbilder/periphere-arterielle-verschlusskrankheit ; zuletzt aufgerufen am 2. 2. 2021
Wagner JW: The dysvascular foot: a system for diagnosis and treatment. Foot Ankle 1981; 2(2): 64-122
Armstrong DG et al.: Validation of a diabetic wound classification system. The contribution of depth, infection, and ischemia to risk of amputation. Diabetes Care 1998; 21(5): 855-9
Pflugradt A et al.: WZ-VS-018 V03 Standardvorgehensweise zur Wundreinigung. Wundzentrum Hamburg 2019; 1-6
Poll LW, Chantelau E: Charcot-Fuß: Auf die frühe Diagnose kommt es an. Dtsch Ärztebl 2010; 107(7): A-272/B-238/C-234