17. März 2023
Brauchen wir Biomaterialien in der Knorpelregeneration?
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf allgemeineplus.at und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. universimed.com & med-Diplom.at)
Über die letzten Jahrzehnte haben sich im Bereich der operativen Knorpelrekonstruktion vielversprechende Therapiemöglichkeiten etabliert, bei deren Anwendung auf biologische Trägermaterialien zur Deckung des Knorpelschadens zurückgegriffen wird. Neue bzw. weiterentwickelte Methoden verzichten nun teilweise auf Trägermaterialien zugunsten rein autologer Matrix. Der Artikel soll einen Überblick über verfügbare Techniken zur Knorpelrekonstruktion erörtern und die Vor- und Nachteile der Verwendung von Biomaterialien aufzeigen.
Knorpelschäden unterschiedlicher Genese – meist traumatisch oder degenerativ bedingt – sind im klinischen Alltag sehr häufig und aufgrund ihrer Entstehung sehr differenziert zu betrachten.1 Während es für degenerative Knorpelschäden derzeit nur eingeschränkte Behandlungsmöglichkeiten (z.B. Infiltrationstherapien mit Hyaluronsäure, PRP etc.) gibt, sieht das für die Regeneration von traumatisch oder idiopathisch bedingten Knorpelschäden vielversprechender aus. Über die letzten Jahrzehnte haben sich einige Therapieansätze – autologe Chondrozytentransplantation (ACT) und osteochondrale Transplantation sowie knochenmarkstimulierende Prozeduren (Nanofrakturierung, Mikrofrakturierung) – etabliert, welche über die Jahre gute, jedoch unterschiedliche klinische Ergebnisse zeigten.
Die erste Generation der ACT (Erstpublikation durch Matts Brittberg und Lars Peterson im Jahr 1994), bei der als Defektdeckung ein Periostlappen verwendet wurde, hat in einer Reihe von Studien gute Ergebnisse im Hinblick auf Klinik und Knorpelqualität gebracht. Die periostale Gewebehypertrophie, die Delaminierung, die Arthrofibrose und das Transplantatversagen müssen in diesem Zusammenhang als mögliche Komplikationen erwähnt werden. Die Versagensrate ist mit 2–8% jedoch gering.
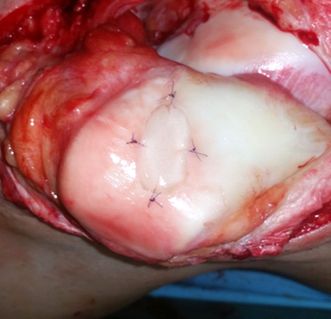
Abb. 1: MACT an einem retropatellaren Knorpeldefekt, Fixation des Transplantates an den umliegenden Knorpel mit resorbierbaren Fäden
Die nächsten Generationen, auch als matrixassoziierte Chondrozytentransplantation (MACT) bezeichnet, verwendeten in der Frühphase eine Kollagenmembran zur Defektdeckung (2. Generation). In der Weiterentwicklung wurden die Chondrozyten vor der Operation auf ein dreidimensionales Trägermaterial aufgebracht (3. Generation, Abb. 1). Dies brachte nicht nur Vorteile bei der Handhabung während der Operation, sondern zeigte auch in Hinblick auf die Füllqualität des Knorpelgewebes bessere Ergebnisse und führte zu einer Reduktion der Versagensrate im Vergleich zur ACT.3,4 Nachteile der (M)ACT sind jedoch das zweizeitige Vorgehen und die hohen Kosten der Produktion. Die Einstufung der Technik durch die europäische Gesundheitsbehörde als „Advanced Therapy Medicinal Product“ (ATMP) und die dadurch bedingten aufwendigen Auflagen haben dazu mit Sicherheit einen großen Teil beigetragen.
Durch knochenmarkstimulierende Techniken wird vor allem Faserknorpel gebildet, mit entsprechenden qualitativen Einschränkungen in Hinblick auf die histologische Struktur und die Tendenz zur intraläsionalen Osteophytenbildung. Es gibt eine Reihe von Studien, die eine Verbesserung des klinischen Outcomes in Abhängigkeit von der Defektgröße und des Patientenalters zeigen. Aufgrund der intraläsionalen Osteophytenbildung und mangelnder Knorpelqualität und -quantität gibt es jedoch im 5-Jahres-Follow-up ausgeprägte Limitationen in Bezug auf das klinische Outcome. Im Vergleich zur MACT zeigen die knochenmarksstimulierenden Techniken, wie die Mikrofrakturierung, klinisch statistisch signifikant schlechtere Ergebnisse.8 Auch bei der autologen matrixinduzierten Chondrogenese (AMIC), bei der ein Trägermaterial die Anhaftung und Differenzierung von Knochenmarkstammzellen in Richtung Chondrozyten fördern soll, können die teils guten klinischen Ergebnisse bei kleinen bis mittelgroßen Defekten häufig nicht durch MRT-Befunde bestätigt werden.2
Vor diesem Hintergrund stellt sich nun die Frage, ob im Rahmen der Knorpelregeneration überhaupt Füllmaterialien benötigt werden oder ob es Alternativen gibt. Und wenn Füllmaterial nötig ist, welche Arten haben die besten Eigenschaften für die Knorpelintegration?
Die Definition der Eigenschaften von Biomaterialien der Europäischen Gesellschaft für Biomaterialien („material intended to interface with biological systems to evaluate, treat, augment or replace any tissue, organ or function of the body“) legt viel Bedeutung auf die Interaktion des Biomaterials mit biologischen Systemen. Neben diesen unmittelbaren Wechselwirkungen spielen in der klinischen Realität noch viele weitere Einflussfaktoren eine Rolle für das klinische Ergebnis; beim Gelenksknorpel im Kniegelenk beispielsweise: Beinachsenfehlstellungen, Körpergewicht, genetische Voraussetzungen oder traumatisch bedingte Einflüsse (knöchern, ligamentär).
Um Gewebe erfolgreich züchten zu können, braucht es ein Zusammenspiel von gewonnenen Zellen, Wachstumsfaktoren und dem Biomaterial selbst – all das kultiviert unter Laborbedingungen. Die Kosten dafür sind derzeit oft sehr hoch und vor dem Hintergrund großer Budgetlöcher in so manchen Gesundheitshaushalten schwer zu stemmen. Daher sollten auch Alternativen für eine breitere Anwendung von Knorpelersatzmaterialien für die Vielzahl an zu versorgenden Patient*innen implementiert werden, die vergleichbar gute klinische Effekte zeigen.
Bevor mögliche Alternativen aufgezeigt werden, soll noch auf das Anforderungsprofil von biologischen Trägermaterialien (Scaffolds) eingegangen werden. Diese müssen vor allem folgende Eigenschaften haben:
-
gute Biokompatibilität: Zelladhäsion, Zellfunktion, Zellmigration, Zellproliferation, Matrixproduktion und Akkumulation, vernachlässigbare Immunreaktion;
-
gute Biodegradierbarkeit: Ziel des Tissue Engineering ist der Ersatz der implantierten Matrix durch körpereigenes Gewebe; die Matrix muss degradierbar sein, um Zellen die Produktion eigener Matrix zu ermöglichen; Abbauprodukte dürfen nicht toxisch sein, keine Immunantwort hervorrufen und keine Organe schädigen;
-
mechanische Eigenschaften: idealerweise ähnliche Eigenschaften wie das zu ersetzende Gewebe; fest genug, um Handhabung bei der Operation zu ermöglichen; ausreichend mechanische Stabilität, um von der Implantation bis zum abgeschlossenen Remodeling die gewünschte Funktion auszuüben; geeignet, interindividuelle Unterschiede (Alter, Gewicht) auszugleichen;
-
Architektur des Scaffolds: miteinander verbundene Porenstruktur und gute Durchlässigkeit; eine große Herausforderung im Tissue Engineering ist die Kerndegradation, bedingt durch fehlende Vaskularisierung und Abtransport von Abbauprodukten aus dem Kerngebiet;
-
Herstellungstechnik: Wichtige Voraussetzungen für die klinische Umsetzung sind kosteneffektive Produktion, Produktion im großen Maßstab, GMP-Tauglichkeit, Haltbarkeit für Lagerung und Transport.
Nach diesem Anforderungsprofil haben verschiedene Hersteller unterschiedliche Matrices entwickelt: Hydrogele, Membranen, Vliese und Schwämme. Im Aufbau unterscheiden sie sich vor allem hinsichtlich der Struktur und der Materialien. Bei Matrixmaterialien kann man vor allem zwei Arten unterscheiden: synthetisch hergestellte Stoffe (PGA – „polyglycolic acid“, PLA – „polylactic acid“, PLGA – „polylactic-co-glycolic acid“, Polaxomere) und biologische Materialien (Kollagene, Fibrin, Alginate, Agarose, Hyaluronsäure und Chitosan). Synthetische Stoffe haben vor allem in Hinblick auf Zelladhäsion und Biointegration Nachteile, biologische Materialien bei der mechanischen Widerstandsfähigkeit und Biodegradierbarkeit.
Die zu verwendenden Materialien matrixbasierender Systeme sollten nicht die Materialdichte von 50–100µm unterschreiten. Die Chondrozytenadhäsion, -verteilung, -morphologie und -differenzierung wird vor allem durch die Materialzusammensetzung und ihre Struktur beeinflusst.5 Es zeigte sich, dass besonders diese spezifischen matrixbedingten Eigenschaften großen Einfluss auf die Genexpression und die Zelldifferenzierung des gebildeten Knorpels haben und somit auch ein wichtiger Faktor für den Erfolg der MACT sind. Diese Ergebnisse und deren klinischer Effekt können auch noch 5 Jahre postoperativ beobachtet werden.7 Jedoch erreichen die Genexpressionswerte der MACT trotz 3D-Kultivierung nicht die des nativen Knorpels.6
Matrixfreie ACT-Prozeduren haben die positive Eigenschaft, dass die autologe Matrixbildung nicht durch schädliche Oberflächenbeschaffenheiten und Degradationsprodukte des Scaffolds gehemmt wird. Sie entsprechen eher den Mechanismen der embryonalen Knorpelentwicklung (mesenchymale Kondensation). Das Transplantat ist vollständig biologisch mit hoher Biokompatibilität, die hohe Zellularität verbessert die Integration in den umliegenden Knorpel. Nachteilig ist der langwierige Prozess der Selbstorganisation.
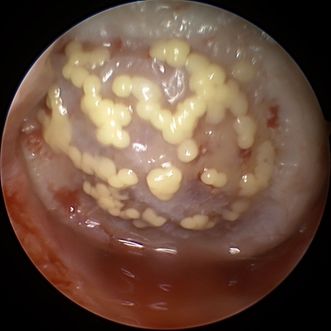
Abb. 2: In einen Knorpeldefekt am medialen Femurknodyl arthroskopisch implantierte Sphäroide (Spherox®)
Ein Beispiel für die matrixfreie ACT ist die Spheroidtechnologie (Spherox®, Abb. 2). Die Spherox®-Implantation erfolgt wie bei der MACT zweizeitig. Ein Ersteingriff ist für die Gewinnung der Knorpelzellen aus nicht tragenden Regionen des Kniegelenks notwendig. Nach einer Kultivierungsphase ist die Implantation nach rund 6–8 Wochen möglich. Neben den genannten Vorteilen eines matrixfreien Systems ist ein weiterer, dass die Implantation im Großteil der Fälle arthroskopisch möglich ist, was auch eine geringere Morbidität im Vergleich zur Miniarthrotomie (MACT) nach sich zieht. Europaweit zugelassen ist die Spheroidtechnologie derzeit an den Femurkondylen und an der Patella bei bis zu 10cm2 großen Knorpelschäden (ICRS Gr. III–IV), seit Mai 2021 auch bei Jugendlichen mit geschlossenen Wachstumsfugen.9 Klinische Ergebnisse nach Spherox®-Implantation (Follow-up bis 5 Jahre) sind sehr vielversprechend und zeigen statistisch signifikante Verbesserungen auch im Vergleich zur Mikrofakturierung.10
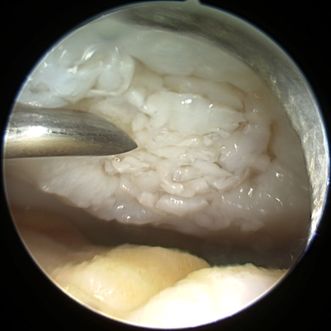
Eine weitere matrixfreie, arthroskopisch basierte Methode zur Behandlung von Knorpeldefekten ist die „Minced Cartilage“-Methode (AutoCart™, Arthrex, Abb. 3). Für das Verfahren ist keine Knorpelzell-Kultivierungsphase undebenso keine Matrix zur Implantation notwendig, gemäß dem Prinzip der vollständig autologen Knorpelregeneration. Anstatt Knorpelzellen zu isolieren, werden kleinste Knorpelstücke mit dem Shaver direkt vom Rand des Knorpeldefektes oder den nicht gewichttragenden Anteilen des Kniegelenks entnommen, mit autologem konditioniertem Plasma (ACP) zu einer Paste vermischt und anschließend in den Defekt eingebracht. Die großen Vorteile der Technik sind das einzeitige Vorgehen, die arthroskopische Anwendung, das rein autologe Gewebematerial und die Kosteneffektivität. Klinische Langzeitergebnisse sind jedoch noch abzuwarten, um einen Vergleich mit der (M)ACT anzustellen.
Es gibt eine Vielzahl an Möglichkeiten, um Knorpeldefekte operativ zu versorgen. Die wichtigsten Entscheidungsfaktoren sind dabei das Ausmaß und die Lokalisation des Knorpeldefekts selbst, ebenso wie das Patientenalter und der Anspruch an das Gelenk. Die Auswahl des Therapieverfahrens ist in bestimmten Fällen auch abhängig von der Finanzierbarkeit des Eingriffes und der Compliance der Patient*innen. Der Einsatz von matrixbasierten Biomaterialien, unabhängig davon, ob im Rahmen einer MACT oder bei knochenmarkstimulierenden Methoden, muss vor dem Hintergrund der zu erwartenden Abbauprodukte und deren Wechselwirkungen im Gelenk auch kritisch betrachtet werden. Matrixfreie Systeme stellen oft eine gute, leicht anzuwendende, mit guten klinischen Ergebnissen verbundene Alternative dar.